Modificazioni di un equilibrio chimico il principio di Le Chatelier
Modificazioni di un equilibrio chimico il principio di Le Chatelier
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Modificazioni di un equilibrio chimico il principio di Le Chatelier
Di particolare interesse pratico nello studio degli equilibri chimici è l'analisi dei fattori che in qualche modo possano influire sull'equilibrio, spostandolo verso le specie chimiche che si desidera ottenere.
Il principio di Le Chatelier ci offre un criterio generale per prevedere lo spostamento di un equilibrio in risposta a sollecitazioni esterne.
Il principio afferma infatti che un sistema in equilibrio tende a mantenerlo inalterato, neutralizzando per quanto possibile qualsiasi azione di disturbo esterna.
Per quanto riguarda un equilibrio chimico possiamo affermare che se esso viene sottoposto ad un'azione perturbatrice esterna, l'equilibrio si sposterà, facendo variare le concentrazioni di equilibrio delle specie chimiche, in modo tale da rendere minimi gli effetti della perturbazione.
Prima di analizzare le diverse perturbazioni cui può essere sottoposto un equilibrio chimico e gli spostamenti relativi, prevedibili sulla base del principio di Le Chatelier, ricordiamo che il valore della costante di equilibrio viene modificato solo da variazioni della temperatura, mentre rimane costante per ogni altra modificazione delle condizioni sperimentali.
1) Modificazione delle concentrazioni
Applicando il principio di Le Chatelier possiamo prevedere che in risposta ad una variazione nella concentrazione di una delle specie chimiche che partecipa alla reazione, l'equilibrio si sposti in modo da riottenere la concentrazione originaria.
In altre parole se aumentiamo la concentrazione di una specie chimica l'equilibrio si sposterà dalla parte opposta, se invece diminuiamo la concentrazione di una specie chimica l'equilibrio si sposterà verso il lato della reazione in cui è presente la specie la cui concentrazione è diminuita.
Per esemplificare quanto detto ricalcoliamo le concentrazioni di equilibrio per la reazione
H2 + I2 « 2HI
nell'ipotesi che la concentrazione iniziale dello iodio sia maggiore di quella osservata nell'esempio precedente. Ad esempio potremmo introdurre non 0,8 moli, ma 1,2 moli di I2. Costruiamo una nuova tabella
concentrazioni iniziali concentrazioni all'equilibrio
H2 2/1,6 = 1,25 mol/l 1,25 - X mol/l
I2 1,2/1,6 = 0,75 mol/l 0,75 - X mol/l
HI 0 mol/l 2X mol/l
Utilizziamo ora i valori delle concentrazioni di equilibrio, espresse in funzione di X, all'interno delle legge di azione di massa
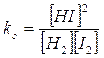
e, sostituendo opportunamente le concentrazioni di equilibrio
si ottiene un'equazione di secondo grado che risolta fornisce la seguente soluzione
X = 0,68
La concentrazione di equilibrio dell'acido iodidrico sarà pertanto pari a
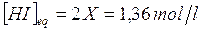
maggiore delle 0,95 mol/l che rappresentava la concentrazione di equilibrio nelle precedenti condizioni. Come si può osservare l'equilibrio si è spostato verso destra, cercando in questo modo di diminuire la concentrazione del reagente I2, che era stata aumentata.
Un modo per far avvenire completamente una reazione è ad esempio quello di eliminare continuamente i prodotti di reazione mentre si formano (non sempre è comunque possibile). In questo modo infatti la reazione si sposta continuamente verso destra fino a che tutti i reagenti non si sono trasformati in prodotti di reazione, senza essere mai in grado di raggiungere l'equilibrio.
Un altro modo di spostare una reazione verso i prodotti di reazione è di farla avvenire con un eccesso di un reagente sugli altri.
2) Modificazione della pressione
Le modificazioni della pressione incidono solo sulle reazioni che decorrono in fase gassosa, in quanto liquidi e solidi sono praticamente incomprimibili.
In base al principio di Le Chatelier possiamo prevedere che una reazione in fase gassosa reagisca ad un aumento di pressione esterna spostando il suo equilibrio in modo da rendere minimo tale aumento. In altre parole l'equilibrio si sposterà in modo da ridurre il numero complessivo di molecole presenti all'equilibrio (la pressione è infatti direttamente proporzionale al numero di particelle presenti) e quindi verso il lato della reazione in cui è complessivamente minore il numero di moli gassose.
Da quanto detto risulta evidente che risentono di variazioni di pressione solo le reazioni gassose in cui il numero totale di moli dei reagenti è diverso dal numero totale di moli dei prodotti di reazione. Nel caso in cui il numero di moli gassose dei reagenti sia uguale al numero di moli gassose dei prodotti l’equilibrio risulta indifferente ad un cambiamento di pressione
Prendiamo ad esempio i seguenti tre equilibri gassosi e sottoponiamoli idealmente ad un aumento di pressione
aumento di pressione
N2 + 3H2 « 2NH3 spostamento verso destra
PCl5 « PCl3 + Cl2 spostamento verso sinistra
2HI « H2 + I2 indifferente
ESEMPIO
In un recipiente di 10 litri vengono introdotte 0,8 moli di N2O4 (ipoazotide). Alla temperatura di 299°K si stabilisce il seguente equilibrio
la cui costante alla suddetta temeratura è kp = 0,172. Calcolare come varia la concentrazione di equilibrio del biossido di azoto dopo aver portato il volume del recipiente da 10 litri a 2 litri, mantenendo costante la temperatura.
Calcoliamo le pressioni iniziale dell'ipoazotide
Calcoliamo ora la pressione di equilibrio del biossido di azoto, osservando che per x moli di N2O4 che reagiscono si formano 2x moli di biossido e ricordando che le variazioni di pressione sono direttamente proporzionali alle variazioni nel numero di moli.
Pressione iniziale Pressione di equilibrio
N2O4 1,96 1,96 - X
NO2 0 2X
Utilizziamo ora i valori delle pressioni di equilibrio, espresse in funzione di X, all'interno delle legge di azione di massa
e sostituendo opportunamente
che, risolta, da il seguente valore X = 0,27 atm
La pressione parziale delle specie chimiche all'equilibrio è dunque pari a
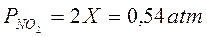
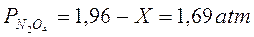
Osserviamo come la pressione dell'ipoazotide sia all'equilibrio circa 3 volte maggiore di quella del biossido di azoto.
Calcoliamo ora le pressioni parziali di equilibrio dopo che il volume è stato portato da 10 a 2 litri, con un relativo aumento della pressione esercitata sulla miscela gassosa.
La nuova pressione iniziale per l'ipoazotide sarà ora pari a
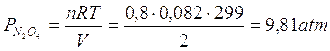
L'equazione di equilibrio diventa
X vale ora 0,63 e le nuove pressioni di equilibrio saranno
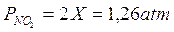
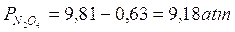
Osserviamo come dopo aver compresso la miscela gassosa la pressione dell'ipoazotide sia ora circa 7 volte maggiore di quella del biossido.
L'equilibrio si è dunque spostato verso sinistra, dove minore era il numero di moli.
3) Variazione della temperatura
In base al principio di Le Chatelier una reazione reagisce ad un aumento di temperatura modificando le condizioni di equilibrio al fine di rendere minimo l'effetto dell'apporto di calore.
Lo spostamento sarà quindi differente a seconda che la reazione sia esotermica o endotermica.
Per prevedere in modo semplice le variazioni dell'equilibrio è possibile trattare il calore di reazione come un reagente nelle reazioni endotermiche e come un prodotto di reazione nelle reazioni esotermiche.
reazione endotermica A + B + calore « C + D
reazione esotermica A1 + B1 « C1 + D1 + calore
- In tal modo se aumentiamo la temperatura, fornendo calore ad una reazione endotermica, la reazione si sposterà verso i prodotti di reazione, poichè in tal modo il calore fornito viene assorbito per formare i composti più energetici. Se aumentiamo invece la temperatura in una reazione esotermica, l'equilibrio si sposta, per lo stesso motivo, verso i reagenti.
- Una diminuzione di temperatura sposta invece i due equilibri in senso opposto, verso il lato in cui compare il calore. In tal modo la reazione si oppone alla diminuzione di temperatura producendo calore.
Le variazioni di temperatura modificano anche il valore della costante di equilibrio, la quale assumerà pertanto valori più elevati se l'equilibrio si sposta verso destra e valori minori se l'equilibrio si sposta verso sinistra.
Tale comportamento può essere interpretato ricordando che la costante di equilibrio si ottiene come rapporto tra le costanti di velocità della reazione diretta e della reazione inversa.
Nel grafico che segue si può osservare come in una reazione esotermica l'energia di attivazione della reazione diretta è maggiore dell'energia di attivazione della reazione inversa.
Come abbiamo già avuto modo di dire, quanto più elevata è l'energia di attivazione tanto più sensibile risulta la velocità di una reazione agli aumenti di temperatura. Per questo motivo un aumento di temperatura accelera maggiormente la reazione inversa (con grande Eatt) della reazione diretta (con piccola Eatt). Ciò implica che kinv aumenta di più di kdir ed il loro rapporto (kc) a temperature maggiori risulta pertanto più piccolo.
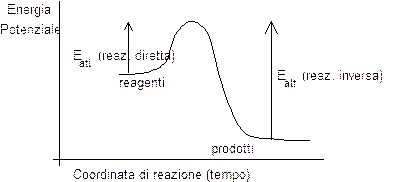
Molto spesso è necessario scegliere con grande attenzione le condizioni in cui far avvenire una reazione, poichè facendo variare certi parametri possono ottenersi benefici in termini di resa di una reazione, pagandoli però in termini di velocità. Un tipico esempio di quanto affermato è il processo Haber-Bosch per la produzione dell'ammoniaca, a partire da idrogeno e azoto gassosi
Come si può osservare il processo è esotermico e se vogliamo aumentare la resa di ammoniaca dobbiamo lavorare a basse temperature per spostare l'equilibrio verso destra. In tal modo però la velocità di reazione diventa talmente bassa da risultare economicamente inaccettabile. Aumentando la temperatura aumenta la velocità di reazione, ma l'equilibrio si sposta verso sinistra e la resa in ammoniaca diminuisce drasticamente. La soluzione, proposta da Haber, consiste nel mantenere elevata la temperatura per consentire una velocità di reazione accettabile e di spostare l'equilibrio verso destra, per aumentare la resa, lavorando a pressioni elevate ( la reazione si svolge infatti in fase gassosa ed i prodotti di reazione sono presenti con un numero di moli inferiore rispetto ai reagenti).
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Modificazioni di un equilibrio chimico il principio di Le Chatelier tipo file : doc
Modificazioni di un equilibrio chimico il principio di Le Chatelier
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Modificazioni di un equilibrio chimico il principio di Le Chatelier utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Modificazioni di un equilibrio chimico il principio di Le Chatelier
Termini d' uso e privacy