Osmosi e Pressione osmotica
Osmosi e Pressione osmotica
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Osmosi e Pressione osmotica
Il fenomeno dell'osmosi si produce ogniqualvolta una soluzione a maggior concentrazione è separata da una a minor concentrazione da una membrana semipermeabile, che permette il passaggio selettivo del solvente, ma non del soluto.
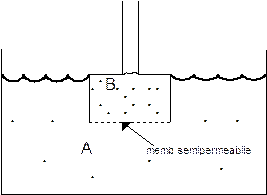
In condizioni normali il soluto, più concentrato nel recipiente B, tenderebbe a diffondere nel recipiente A, mentre il solvente, più concentrato nel recipiente A, tenderebbe a diffondere nel recipiente B.
Poichè il movimento di diffusione del soluto è impedito dalla presenza della membrana semipermeabile, l'unico movimento consentito è quello del solvente che diffonde dalla soluzione più diluita (A) verso la soluzione più concentrata (B). Il fenomeno è noto come osmosi.
Il risultato finale è sempre quello di eliminare le differenze di concentrazione, infatti la soluzione A, inizialmente più diluita, tende a concentrarsi per la fuoriuscita del solvente, mentre il contrario avviene per la soluzione B.
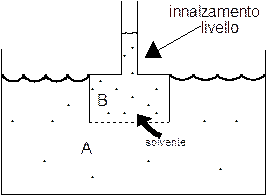
L'entrata del solvente nella soluzione più concentrata (B) provoca un aumento del volume della soluzione. Il livello del liquido si alza fino al punto in cui la pressione esercita dalla colonna di liquido innalzatasi fa esattamente equilibrio alla pressione esercitata dal solvente in entrata.
Quando viene raggiunto l'equilibrio è quindi possibile utilizzare il peso della colonna d'acqua come misura della pressione esercitata dal solvente in entrata, o pressione osmotica, p.
Sperimentalmente si osserva che la pressione osmotica prodotta da una soluzione rispetto al solvente puro obbedisce all'equazione di stato dei gas perfetti
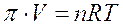
dove V = volume della soluzione ed n = numero di moli di soluto
Tenendo conto poi che n/V è la molarità della soluzione, la relazione diventa
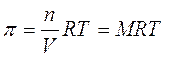
La pressione osmotica di una soluzione, a temperatura costante, dipende dunque esclusivamente dalla sua concentrazione.
Nel caso si prendano in considerazione 2 soluzioni a diversa concentrazione, la pressione osmotica è proporzionale alla differenza di concentrazione DM.
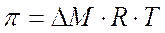
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Osmosi e Pressione osmotica tipo file : doc
Osmosi e Pressione osmotica
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Osmosi e Pressione osmotica utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Osmosi e Pressione osmotica
Termini d' uso e privacy