Risonanza e delocalizzazione degli elettroni
Risonanza e delocalizzazione degli elettroni
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Risonanza e delocalizzazione degli elettroni
Si ritiene che il fenomeno della risonanza vada per lo più associato alla maggior stabilità che un composto acquisisce quando può delocalizzare gli elettroni di legame su tutta la molecola o su parte di essa.
In altre parole il doppietto elettronico presente nell'orbitale di legame p non risulta confinato tra i due atomi inizialmente impegnati nel legame, ma si distribuisce su di un numero maggiore di atomi.
In certi casi tale condizione può essere graficamente rappresentata senza ricorrere alle formule limite. Ad esempio l'anidride solforosa può essere rappresentata anche così
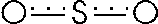
Con gli elettroni delocalizzati su tutta la molecola indicati dalla linea tratteggiata. Ciascun legame zolfo - ossigeno può essere pensato come "un legame e mezzo".
Un altro importante esempio di delocalizzazione elettronica si ha nel benzene C6H6. un composto organico in cui i 6 atomi di carbonio si chiudono a formare un esagono. Ciascun atomo di carbonio è ibridato sp2 ed impegna i tre orbitali sp2 per legarsi ad un idrogeno e ad altri due atomi di carbonio. L'orbitale pz non ibridato viene utilizzato per formare un legame con un carbonio adiacente. Si dovrebbe pertanto ritenere che i 6 atomi di carbonio siano uniti all'interno dell'anello da una serie di legami semplici alternati a legami doppi.
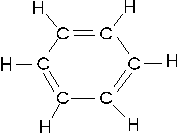
In realtà i sei legami C - C risultano essere perfettamente identici e a metà strada tra un legame semplice ed un legame doppio.
Descriviamo dunque il benzene come un ibrido di risonanza delle due seguenti strutture limite
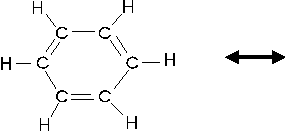
oppure, in modo del tutto equivalente, rappresentiamo le tre coppie di elettroni delocalizzati su tutta la molecola con un anello interno all'esagono
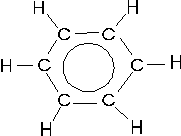
La delocalizzazione degli elettroni è in grado di spiegare in modo soddisfacente anche l'esistenza di molecole con carenza di elettroni.
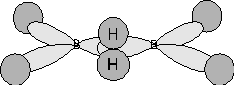
Il diborano, B2H6, ad esempio è una molecola di questo tipo. Ogni atomo di boro possiede infatti solo 3 elettroni. Se li utilizziamo tutti per giustificare i 6 legami con altrettanti atomi di idrogeno, non ci rimangono più elettroni disponibili per giustificare il legame esistente tra i due atomi di boro.
Dati sperimentali suggeriscono che il boro sia ibridato sp2. Si ritiene che ciascun atomo di boro utilizzi due orbitali sp2 per legare due atomi di idrogeno ed il rimanente orbitale sp2 per legarsi con l'altro atomo di boro.
Quest'ultimo legame si sovrappone infine a due orbitali s di altri due atomi di idrogeno che si dispongono centralmente, uno sopra ed uno sotto il piano di ibridazione. Si forma un unico orbitale molecolare, costituito dalla fusione dei due orbitali s degli idrogeni e di due orbitali sp2, delocalizzato su tutta la molecola e contenente 4 elettroni.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Risonanza e delocalizzazione degli elettroni tipo file : doc
Risonanza e delocalizzazione degli elettroni
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Risonanza e delocalizzazione degli elettroni utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Risonanza e delocalizzazione degli elettroni
Termini d' uso e privacy