Soluzioni tampone
Soluzioni tampone
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Soluzioni tampone
Si dicono tamponate quelle soluzioni acquose che conservano praticamente immutato il proprio pH anche dopo l'aggiunta di piccole quantità di acidi o basi.
I tamponi hanno una straordinaria importanza biologica, infatti moltissime soluzioni biologiche (sangue, linfa, succhi gastrici etc) richiedono il mantenimento di un pH costante.
L'effetto tampone si ottiene sciogliendo in acqua un acido debole con un suo sale o una base debole con il relativo sale.
Consideriamo ad esempio una soluzione contenente un generico acido debole HA ed il suo sale di sodio NaA.
L'acido debole è presente in soluzione quasi totalmente indissociato essendo il suo equilibrio fortemente spostato verso sinistra.
Il sale dell'acido, come la maggior parte dei sali, è invece completamente dissociato
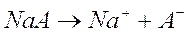
Essendo un elettrolita forte il sale rimane completamente dissociato anche in presenza dell'acido debole.
L'equilibrio di dissociazione dell'acido viene invece disturbato dalla presenza degli ioni A- prodotti dalla dissociazione del sale, ed il suo equilibrio retrocede spostandosi ulteriormente verso sinistra.
Per calcolare il pH di una soluzione tampone determiniamo le concentrazioni di equilibrio. Poiché il sale si dissocia completamente esso produce una quantità di ioni A- pari alla sua concentrazione iniziale. Se indichiamo con Msale la concentrazione iniziale del sale (molarità), possiamo scrivere

Ora descriviamo l’equilibrio di dissociazione dell’acido debole HA che si dissocia, in presenza di [A-] = Msale, in x ioni H+ e x ioni A-
|
iniziale |
d'equilibrio |
[HA]
|
Macido
|
Macido - X
|
[H+]
|
0
|
X
|
[A-]
|
Msale
|
Msale + X
|
Esprimiamo ora le concentrazioni di equilibrio in funzione della ka
Essendo l'acido molto debole la concentrazione di equilibrio degli ioni H+ è molto piccola ed in genere trascurabile rispetto alle concentrazioni iniziali dell'acido (Macido) e del sale (Msale), specialmente se queste sono sufficientemente elevate.
Per questo motivo è possibile trascurare la X nella somma a numeratore e nella differenza a denominatore. La relazione diventa quindi
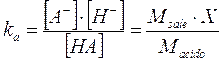
dalla quale otteniamo
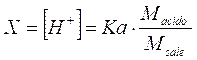
Calcolando il logaritmo negativo di entrambi i membri otteniamo finalmente la relazione per il calcolo del pH in soluzioni tampone
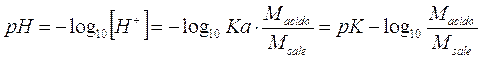
Se ad esempio costruiamo una soluzione tampone in cui sono presenti 10-2 mol/l di acido fluoridrico (ka = 3,53.10-4) e 10-1 mol/l di fluoruro di sodio, la soluzione risulta tamponata a

Meccanismo d'azione di una soluzione tampone
Cerchiamo ora di capire per qual motivo una soluzione tampone è in grado di mantenere praticamente invariato il suo pH.
Come si può osservare in una soluzione tampone sono presenti in elevata concentrazione sia l'acido debole indissociato che il suo anione (quest'ultimo prodotto dalla dissociazione del sale). Si noti che se fosse presente solo l'acido debole la concentrazione del suo anione sarebbe invece molto bassa in quanto l'acido è poco dissociato.
Ora se aggiungiamo alla soluzione un acido forte, gli ioni H+ prodotti dalla sua completa dissociazione tendono a combinarsi con gli ioni A- della soluzione tampone per dare l'acido debole indissociato HA. Naturalmente il processo risulta efficiente solo se in soluzione è presente una elevata concentrazione di ioni A-.
Se invece viene addizionata una base forte gli ioni OH- prodotti dalla sua completa dissociazione si uniscono agli ioni H+ prodotti dall'acido debole per dare acqua indissociata (l'equilibrio di dissociazione dell'acqua è infatti molto spostato verso sinistra, kw piccola). Naturalmente man mano che gli ioni H+ vengono sottratti all'equilibrio dell'acido debole, quest'ultimo, per il principio di Le Chatelier, si dissocia ulteriormente fornendo altri ioni H+ che vanno a neutralizzare gli ioni OH-.
Anche in questo caso il processo risulta efficiente solo se nella soluzione tampone è presente una elevata quantità di acido debole indissociato in grado di fornire ioni H+.
Il meccanismo d'azione di una soluzione tampone si fonda dunque sulla presenza contemporanea di una elevata concentrazione di acido debole e del suo anione.
Osservando la relazione per il calcolo del pH di una soluzione tampone si può osservare come il pH dipenda dal valore della ka e dal rapporto tra la concentrazione dell'acido e del suo sale.
Una soluzione tampone può essere più o meno efficiente. L'efficienza di una soluzione tampone può essere definita sulla base della diversa capacità di mantenere più o meno inalterato il pH a fronte di un'aggiunta di una medesima quantità di acido o base forte. Sono naturalmente più efficienti le soluzioni tampone che riescono a far variare il pH in misura minore.
Si può dimostrare che l'efficienza di una soluzione tampone cresce al crescere della sua concentrazione complessiva.
A parità di concentrazione totale è inoltre più efficiente la soluzione tampone che presenta un rapporto tra la concentrazione dell'acido e quella del sale più vicino all'unità. L'efficienza massima si ottiene quando Macido/Msale = 1. Come si può facilmente verificare in tal caso la soluzione risulta tamponata ad un pH = pK.
Ad esempio possiamo affermare che la soluzione tampone presentata nell'esempio precedente, in cui era stato utilizzato acido fluoridrico (ka = 3,53.10-4), raggiunge la sua massima efficienza quando viene fatta lavorare a pH = pK = -log 3,53.10-4 = 3,45.
Verifichiamo ora con un esempio le condizioni di efficienza delle soluzioni tampone.
a) Variazione della concentrazione totale in una soluzione tampone
Prendiamo in considerazione 2 soluzioni tamponate, la prima più diluita in cui Msale = Macido = 0,4 mol/l, la seconda più concentrata, con Msale = Macido = 0,8 mol/l. Entrambe le soluzioni sono tamponate ad un pH = pK in quanto Macido/Msale = 1.
Osserviamo ora come l'aggiunta di 0,2 mol/l di un acido forte ad entrambe le soluzioni faccia variare il pH della soluzione più diluita in modo più evidente.
L'acido forte è completamente dissociato e libera pertanto 0,2 mol/l di ioni H+, i quali si riassociano con altrettante moli di anione per ridare l'acido debole. All'equilibrio la concentrazione dell'anione (Msale) sarà quindi diminuita di 0,2 mol/l, mentre la concentrazione dell'acido debole (Macido), sarà aumentata in egual misura. Il nuovo pH sarà pertanto
per il 1° tampone 
per il 2° tampone 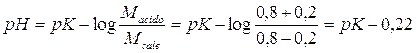
La soluzione tampone più concentrata vede cambiare il suo pH di 0,22 unità contro le 0,48 unita della soluzione più diluita.
b) Variazione del rapporto Macido/Msale in una soluzione tampone.
Prendiamo ora in considerazione due soluzioni tampone che presentano la stessa concentrazione totale, ma diverso rapporto Acido/Sale. Sia la ka = 10-5. La prima avrà Msale = Macido = 0,8 mol/l, la seconda Macido = 1,2 mol/l e Msale = 0,4 mol/l. Aggiungiamo ad entrambe le soluzioni 0,2 mol/l di un acido forte e calcoliamo le relative variazioni di pH
per il 1° tampone il pH passa
da 
a 
con una diminuzione del 4,4%
per il 2° tampone il pH varia
da 
a 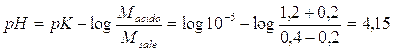
con una diminuzione del 8,2%
Il sangue umano è una soluzione tamponata a pH 7,4. Tra i diversi sistemi tampone presenti nel sangue, il più importante è quello costituito dall'acido carbonico (che si produce dalla reazione dell'anidride carbonica respiratoria con l'acqua) e dallo ione bicarbonato (H2CO3/HCO3-). In effetti lo ione bicarbonato presenta una concentrazione plasmatica circa 10 volte superiore di quella dell'acido carbonico. Il tampone plasmatico H2CO3/HCO3- è quindi lontano dalle condizioni di maggior efficienza. La maggior concentrazione di ioni bicarbonato permette però al sangue di tamponare più facilmente sostanze acide, che rappresentano i principali cataboliti versati nel sangue (acido lattico, acidi urici etc).
In altre parole l'organismo si difende meglio dagli squilibri legati ad eccesso di acidi piuttosto che ad eccessi di basi.
Sapendo che la costante di dissociazione acida dell’acido carbonico è pari a Ka = 4,3 10-7, possiamo scrivere

Calcolo della ka
Un metodo semplice per determinare la costante di dissociazione di un acido ( o di una base) consiste nel misurare il pH di una soluzione che contenga in egual concentrazione l'acido (o la base) ed il suo sale. In tali condizioni infatti pH = pK e quindi [H+] = ka.
Per effettuare praticamente tale misura è possibile aggiungere ad un acido debole di concentrazione nota un numero di equivalenti di una base forte pari alla metà di quelli dell'acido. In tal modo esattamente la metà dell'acido verrà salificata.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Soluzioni tampone tipo file : doc
Soluzioni tampone
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Soluzioni tampone utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Soluzioni tampone
Termini d' uso e privacy