Strategia di bilanciamento delle reazioni redox
Strategia di bilanciamento delle reazioni redox
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Strategia di bilanciamento delle reazioni redox
1) Naturalmente è prima necessario verificare che la reazione sia effettivamente una "redox". E' cioè necessario verificare che almeno due elementi abbiano subito durante la reazione dei cambiamenti nei numeri di ossidazione.
Ciò risulta particolarmente evidente quando un elemento si trova da un lato della linea di reazione allo stato elementare (nox = 0) e dall'altro si trova legato all'interno di un composto (nox 0).
In tutti gli altri casi è necessario calcolare i numeri di ossidazione, scrivendo i numeri di ossidazione variati sopra i rispettivi elementi.

2) si uniscono con una freccia i due atomi dell'elemento che si ossida e con un'altra i due atomi dell'elemento che si riduce. In corrispondenza di ciascuna freccia si scrive la variazione (in aumento o in diminuzione) del nox, moltiplicata per l'indice dell'atomo che reagisce.
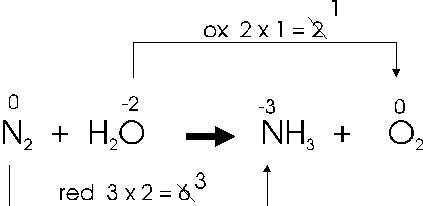
In altre parole i due atomi di azoto che si riducono acquistando ciascuno 3 elettroni, acquistano complessivamente 6 elettroni, mentre l'atomo di ossigeno presente nell'acqua, che si ossida, perde in tutto due elettroni.
3) se i due valori così ottenuti sono divisibili per uno stesso numero, si semplificano. Quindi si utilizza il valore ottenuto dalla reazione di ossidazione, come coefficiente stechiometrico dell'elemento che si riduce e viceversa.

In tal modo abbiamo bilanciato il numero di elettroni trasferiti. Infatti 1 molecola biatomica di azoto acquista complessivamente 6 elettroni, mentre 3 atomi di ossigeno presenti nelle 3 molecole di acqua perdono complessivamente 6 elettroni
4) si procede infine al normale bilanciamento della reazione, ottenendo

Bilanciamento con coefficienti frazionari
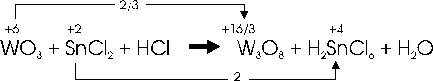
In tal caso è necessario moltiplicare entrambe le differenze trovate (2/3 e 2) per i rispettivi denominatori in modo da ottenere due numeri interi.
Si avrà quindi 2/3 x 3 = 2 e 2 x 3 = 6. Se necessario i due numeri ottenuti si semplificano. Nel nostro caso ad esempio, dividiamo per 2 ottenendo 2 : 2 = 1 e 6 : 2 = 3.
1 e 3 sono i due coefficienti cercati
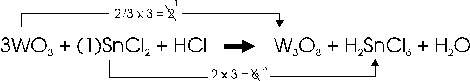
si procede infine al normale bilanciamento della reazione, ottenendo

Reazioni redox di dismutazione o disproporzionamento
Si definiscono dismutazioni quei particolari processi redox in cui alcuni atomi di un elemento si ossidano ed altri si riducono.
Nell'esempio che segue, alcune molecole di ipoclorito si riducono a cloruro, altre si ossidano a clorato

Per bilanciare una reazione di dismutazione è necessario utilizzare le stesse regole viste per le normali reazioni redox, con l'avvertenza di partire dai prodotti di reazione e calcolare le variazioni dei nox nei confronti dei reagenti. I coefficienti stechiometrici, così calcolati, verranno pertanto assegnati ai prodotti di rezione.
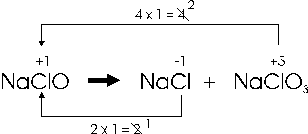
Nell'esempio la variazione del nox tra il cloro del clorato (+5) ed il cloro dell'ipoclorito (+1) è pari a 4, che va moltiplicato per l'indice con cui compare il cloro nel clorato (1). La variazione del nox tra il cloro del cloruro (-1) ed il cloro dell'ipoclorito (+1) è pari a 2, che va moltiplicato per l'idice con cui compare il cloro nel cloruro. Dopo aver semplificato i valori così ottenuti, si assegnano come coefficienti, incrociandoli, ai prodotti di reazione, ottenendo
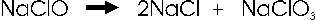
Si completa poi il bilanciamento

Il che significa che ogni tre molecole di ipoclorito che dismuta, due si riducono a cloruro ed una si ossida a ipoclorito.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Strategia di bilanciamento delle reazioni redox tipo file : doc
Strategia di bilanciamento delle reazioni redox
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Strategia di bilanciamento delle reazioni redox utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Strategia di bilanciamento delle reazioni redox
Termini d' uso e privacy