pH in soluzioni molto diluite di acidi e basi forti
pH in soluzioni molto diluite di acidi e basi forti
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
pH in soluzioni molto diluite di acidi e basi forti
Proviamo a calcolare il pH di una soluzione 10-7 M di HCl. Applicando quanto detto in precedenza il pH dovrebbe essere pari a 7. Si arriva cioè al risultato assurdo e paradossale che una soluzione che contiene un acido forte (per quanto molto diluito) è neutra.
In effetti quando la concentrazione di un acido o di una base forte scende sotto le 10-6 mol/l non è più possibile trascurare gli ioni H+ provenienti dalla dissociazione dell'acqua, che, per l'acqua pura sappiamo essere 10-7 mol/l .
E' quindi necessario in questo caso prendere in considerazione contemporaneamente i due equilibri e sommare gli ioni H+ provenienti dall'acido e quelli provenienti dall'acqua
HCl H+ + Cl-
H2O H+ + OH-
Naturalmente non è possibile semplicemente sommare i 10-7 ioni H+ provenienti dall'acido con i 10-7 ioni H+ provenienti dall'acqua pura, infatti mentre l'acido forte rimane completamente dissociato, l'acqua, in presenza dei 10-7 ioni H+ provenienti dall'acido, sposta il suo equilibrio verso sinistra, in risposta all'aumentata concentrazione di uno dei suoi prodotti di reazione (H+). L'apporto di ioni H+ dell'acqua sarà dunque minore di 10-7 mol/l.
Se indichiamo con X gli ioni OH- provenienti dalla dissociazione dell'acqua, gli ioni H+ complessivamente in soluzione saranno dati da X ioni provenienti dall'acqua più 10-7 ioni provenienti dall'acido. Poichè tali concentrazioni devono soddisfare al prodotto ionico dell'acqua potremo scrivere
risolvendo l'equazione di 2° grado si ottiene
X = [OH-] = 6,18*10-8 mol/l [H+] = X + 10-7 = 1,62*10-7
ed il pH risulta perciò pari a
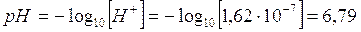
Lo stesso risultato poteva essere ottenuto impostando un sistema di due equazioni con incognite [OH-] e [H+] .
dove la prima equazione è la condizione di equilibrio per la reazione di dissociazione dell'acqua (prodotto ionico) e la seconda è la cosiddetta condizione di elettroneutralità, per cui la soluzione deve essere complessivamente neutra e la somma delle cariche positive deve sempre essere pari alla somma delle cariche negative. Si osservi che [Cl-] non è un'incognita, ma vale in questo caso 10-7 mol/l derivando dalla completa dissociazione dell'acido.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : pH in soluzioni molto diluite di acidi e basi forti tipo file : doc
pH in soluzioni molto diluite di acidi e basi forti
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come pH in soluzioni molto diluite di acidi e basi forti utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
pH in soluzioni molto diluite di acidi e basi forti
Termini d' uso e privacy