Costante di velocità specifica ed equazione di Arrhenius
Costante di velocità specifica ed equazione di Arrhenius
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Costante di velocità specifica ed equazione di Arrhenius
Nel 1889 il chimico svedese Svante Arrhenius propose la seguente relazione per calcolare il valore della costante di velocità specifica
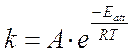
dove
A è una costante che dipende dalla natura dei reagenti
e = 2,718 è la base dei logaritmi naturali o neperiani
Eatt è l'energia di attivazione della reazione
R è la costante universale dei gas
T è la temperatura assoluta
La relazione mostra come la velocità di una reazione, oltre a dipendere naturalmente dal tipo di reazione e dalla natura chimica dei reagenti (ad esempio le reazioni redox sono in genere più lente delle reazioni non-redox), dipende dalla temperatura e da un fattore energetico detto Energia di attivazione.
Il significato fisico della relazione di Arrhenius può essere meglio compreso facendo riferimento alla teoria delle collisioni o teoria degli urti.
Secondo tale teoria affinchè le molecole dei reagenti possano produrre una reazione chimica esse devono urtarsi con un'energia cinetica sufficientemente elevata. L'urto deve cioè essere abbastanza violento da rompere i legami che devono essere spezzati affinchè avvenga la reazione.
La velocità della reazione dipende quindi dalla frequenza degli urti efficaci (sufficientemente energetici e correttamente orientati). In tal modo possiamo anche spiegarci perchè la velocità della reazione aumenta in genere all'aumentare della concentrazione dei reagenti. Infatti una maggior concentrazione aumenta la probabilità che le particelle si urtino e quindi anche la frequenza degli urti tra particelle sufficientemente energetiche.
Ora la meccanica statistica dimostra che, ad una data temperatura, non tutte le particelle possiedono la stessa velocità, ma le velocità si distribuiscono in modo caratteristico secondo una curva di frequenza detta maxwelliana.
L'energia di attivazione può essere quindi definita come la minima energia che deve possedere una particella affinchè il suo urto sia efficace e produca una trasformazione chimica.
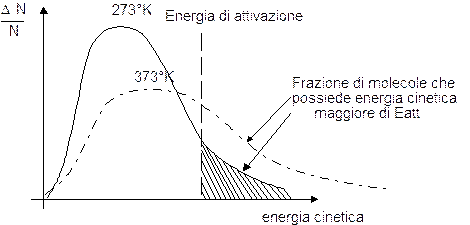
Dall'osservazione del grafico si può facilmente comprendere come all'aumentare della temperatura aumenta anche la frazione di molecole che possiedono energia superiore all'energia di attivazione. In effetti con l'aumentare della temperatura aumenta in generale la frequenza degli urti tra le molecole, ma in questo caso tale fattore risulta trascurabile rispetto al fattore energetico.
Boltzmann dimostrò che il termine esponenziale 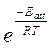 della relazione di Arrhenius esprime effettivamente la frazione di urti che, ad una certa temperatura, presenta energia superiore all'energia di attivazione.
della relazione di Arrhenius esprime effettivamente la frazione di urti che, ad una certa temperatura, presenta energia superiore all'energia di attivazione.
Ad esempio se vogliamo calcolare la fazione di urti efficaci a 30°C in una reazione avente Eatt = 15 KJ/mol, otteniamo
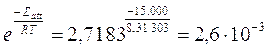
in queste condizioni dunque solo 26 urti su 10.000 risultano efficaci.
Il fatto che la relazione tra frequenza di urti efficaci e temperatura ed energia di attivazione sia di tipo esponenziale ci suggerisce come la velocità di una reazione sia estremamente sensibile alle variazioni di questi due fattori.
Ad esempio se raddoppiamo l'energia di attivazione dell'esempio precedente, portandola a 30 KJ/mol, la frequenza degli urti efficaci diventa
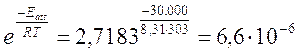
circa 66 urti efficaci su 10 milioni. La reazione è circa 400 volte più lenta.
In altre parole, a parità di altre condizioni, una reazione che presenta un'energia di attivazione molto elevata risulta essere estremamente lenta. In alcuni casi essa può essere talmente lenta da risultare impercettibile.
Naturalmente un modo per accelerare una tale reazione è quello di aumentare la frazione degli urti efficaci, elevando la temperatura.
Se ad esempio aumentiamo la temperatura nella reazione precedente del 50% portandola da 303°K a 454,5°K la frequenza degli urti efficaci diventa
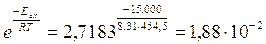
188 urti efficaci su 10.000, con un aumento della velocità di reazione di oltre il 700%
Si tenga comunque presente che l'aumento della velocità di reazione al crescere della temperatura è tanto più evidente quanto maggiore è l'energia di attivazione. Le reazioni caratterizzate da un'elevata energia di attivazione risultano quindi più sensibili alle variazioni di temperatura.
Nel grafico seguente si può osservare come la curva con Eatt = 100 KJ/mol si impenni in modo più vistoso, al crescere della temperatura di quella con Eatt = 50 KJ/mol.
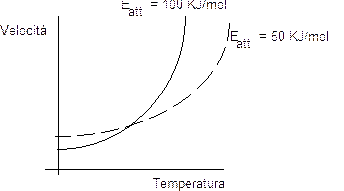
Il valore dell'energia di attivazione di una reazione compare anche quando rappresentiamo la variazione dell'energia potenziale di una reazione rispetto al tempo. In questo caso possiamo immaginare che l’energia cinetica dei reagenti si trasformi in parte nell’energia potenziale del complesso attivato

Secondo tale modello i reagenti, anche nelle reazioni esoergoniche come quella rappresentata nella figura precedente, devono comunque superare una barriera energetica (che coincide con l'energia di attivazione) per potersi trasformare nei prodotti di reazione. Il modello prevede che durante la reazione si formi un composto instabile, detto complesso attivato o stato di transizione, il cui contenuto energetico risulta più elevato e che condiziona la velocità della reazione stessa.
Nelle reazioni a più stadi deve essere superata più di una barriera energetica (si formano diversi stadi di transizione e dei composti intermedi) e la velocità complessiva della reazione dipende evidentemente dallo stadio più lento.
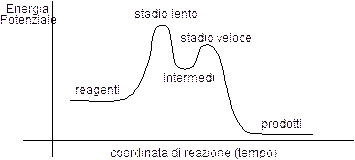
Il fattore A o fattore pre-esponenziale, risulta essere relativamente costante al variare della temperatura e assume un valore caratteristico per ogni reazione. La teoria degli urti esprime il fattore pre-esponenziale come prodotto di due fattori:
- un fattore di probabilità che dipende essenzialmente dalla geometria delle molecole e misura la probabilità che i reagenti, aventi una certa struttura geometrica, si scontrino con un opportuno orientamento.
- un fattore di frequenza che misura la frequenza degli urti (la probabilità che l’urto avvenga) e dipende dalle dimensioni delle particelle, dalla loro massa e dalla loro temperatura.
Le variazioni di temperatura incidono comunque in modo trascurabile sul fattore pre-esponenziale rispetto a quanto non accada per il fattore energetico o fattore esponenziale (frazione degli urti sufficientemente energetici).
Urti efficaci = urti correttamente orientati x frequenza urti x urti sufficientemente energetici
La relazione di Arrhenius può essere utilizzata per calcolare l'energia di attivazione di molte reazioni. Misurando infatti la costante di velocità specifica di una reazione a due temperature diverse T1 e T2 e dividendo membro a membro, si ottiene
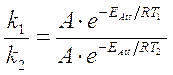
da cui
Ad esempio, sapendo che per la reazione 2N2O à 2N2 + O2, la costante di velocità specifica a 1000°K vale 0,76 s-1, mentre a 1050°K diventa 3,4 s-1
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Costante di velocità specifica ed equazione di Arrhenius tipo file : doc
Costante di velocità specifica ed equazione di Arrhenius
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Costante di velocità specifica ed equazione di Arrhenius utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Costante di velocità specifica ed equazione di Arrhenius
Termini d' uso e privacy