Elettrolisi di una soluzione contenente più ioni precedenza di scarica
Elettrolisi di una soluzione contenente più ioni precedenza di scarica
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Elettrolisi di una soluzione contenente più ioni precedenza di scarica
In una soluzione acquosa di un elettrolita la situazione viene complicata dalla presenza in soluzione di ioni H+ e ioni OH- provenienti dalla parziale dissociazione dell'acqua.
Ad esempio se effettuiamo l'elettrolisi di una soluzione acquosa di cloruro di sodio, possiamo prevedere che all'anodo competeranno per la reazione di ossidazione sia gli ioni Cl- che gli ioni OH-, mentre al catodo si presenteranno gli ioni Na+ e gli ioni H+.
Il problema in questo caso è prevedere quale delle specie ioniche presenti in soluzione e che competono per uno stesso elettrodo ha la precedenza di scarica.
Si verifica sperimentalmente che a parità di concentrazione la precedenza di scarica dipende essenzialmente dalla maggiore o minore tendenza ad acquistare o a cedere elettroni, tendenza che viene misurata attraverso i potenziali standard di riduzione.
Precedenza di scarica al catodo
Tenendo presente che al catodo le specie accettano elettroni e si riducono, è logico attendersi che si ridurrà per prima la specie che presenta il potenziale standard di riduzione più elevato.
Precedenza di scarica all'anodo
Tenendo presente che all'anodo le specie cedono elettroni e si ossidano, è logico attendersi che si ossiderà per prima la specie che presenta il potenziale standard di riduzione più basso.
Nel caso in cui le specie siano presenti in concentrazione non standard è necessario confrontare i potenziali non standard calcolati con l'equazione di Nernst.
Sulla base di tali considerazioni proviamo dunque a prevedere quel che succede in una soluzione acquosa di Ioduro di potassio (KI) 1M.
1) all'anodo competono per la reazione di ossidazione gli ioni OH-, I- e H2O. Le reazioni di riduzione ed i relativi potenziali standard sono
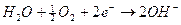 )
)
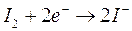 )
)
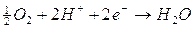 )
)
Se tutte le specie chimiche fossero presenti in concentrazione 1M è evidente che si ossiderebbero per primi gli ioni OH- che presentano un potenziale di riduzione minore con liberazione di ossigeno gassoso all'anodo.
Dobbiamo però tener presente che in una soluzione neutra la concentrazione degli ioni OH- e degli ioni H+ non è 1 M, ma 10-7 M e la pressione parziale dell'ossigeno atmosferico è circa di 0,2 atmosfere. Calcoliamo quindi il potenziale delle coppie redox O2/OH- e H2O/O2 a pH 7, utilizzando l'equazione di Nernst
Come si può osservare a pH 7 il potenziale più basso risulta essere in realtà quello dello iodio (0,54 contro 0,81) che si scarica dunque per primo all'anodo liberando I2 che colora di rosso la soluzione nei pressi dell'elettrodo.
2) Al catodo competono per la scarica gli ioni H+, K+ e l'acqua. Le reazioni di riduzione ed i relativi potenziali standard sono
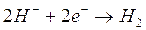 )
)
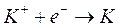 )
)
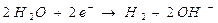 )
)
Anche in questo caso, se tutte le specie chimiche fossero presenti in concentrazione 1M è evidente che si ridurrebbero per primi gli ioni H+ che presentano un potenziale di riduzione di gran lunga maggiore.
Tenendo però presente che in una soluzione neutra la concentrazione degli ioni H+ e degli ioni OH- non è 1 M, ma 10-7 M, dobbiamo applicare l'equazione di Nernest. A pH 7 i potenziali di riduzione assumono i seguenti valori
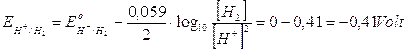
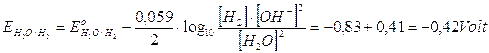
Nonostante la variazione dei potenziali, la liberazione di idrogeno gassoso al catodo rimane la reazione favorita.
Poichè nella soluzione rimangono ioni K+ e ioni OH- , il processo elettrolitico ha prodotto una soluzione di idrossido di potassio.
ALTRI ESEMPI
La soda caustica
In modo analogo l'elettrolisi di una soluzione acquosa di cloruro di sodio, liberando cloro gassoso all'anodo (Cl2) ed idrogeno gassoso al catodo (H2) è in grado di arricchire la soluzione di idrossido di sodio (soda caustica NaOH). L'elettrolisi del cloruro di sodio in soluzione acquosa è il processo industriale per la produzione della soda caustica. Durante la produzione è necessario tener separato il compartimento anodico da quello catodico per evitare che il cloro nascente dismuti, a contatto con l'idrossido di sodio, ridando cloruro ed ipoclorito (varecchina)
2NaOH + Cl2 NaCl +NaClO + H2O
L'acido solforico
Si può ottenere eseguendo l'elettrolisi di un solfato di un metallo il cui potenziale di riduzione sia sufficientemente elevato (maggiore di 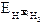 ).
).
Si tenga presente che in una soluzione di solfato rameico il calcolo dei potenziali tramite l'equazione di Nernst deve tener conto del fatto che tale sale da idrolisi acida e quindi il pH 7.
Gli ioni rameici Cu2+ in acqua formano un complesso di coordinazione con 6 molecole d'acqua (ione esaacquo rameico), il quale si comporta come un acido debole dissociandosi secondo la reazione
Cu(H2O)62+ [Cu(H2O)5(OH)]+ + H+
in uno ione pentaacquo-monossi-rameico e uno ione H+. La costante di dissociazione acida dello ione rameico esacoordinato è pari a ka =1,58.10-7.
La concentrazione di ioni H+ di una soluzione 1 M di solfato rameico sarà pertanto
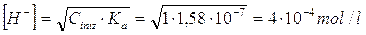
ed il pH = - log 4.10-4 = 3,4
A pH 3,4 i potenziali delle coppie redox che competono per la scarica al catodo diventano
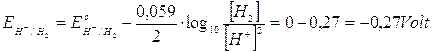
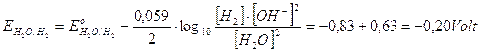
si riduce quindi il rame che presenta un potenziale superiore.
Sempre a pH 3,4 il potenziale delle coppie redox che competono per la scarica all'anodo diventa
Nonostante il potenziale sia ulteriormente salito all'anodo continua a liberarsi ossigeno in quanto il potenziale di riduzione dell'anione solfato rimane di gran lunga più elevato.
Elettrolisi dell'acqua
Se al posto del solfato rameico tentiamo di effettuare l'elettrolisi di un solfato di un metallo il cui potenziale di riduzione sia meno elevato rispetto a quello delle altre coppie redox che competono per la riduzione (ad esempio solfato di sodio 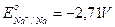 ), allora al catodo si svilupperà idrogeno, mentre all'anodo continuerà a svilupparsi ossigeno.
), allora al catodo si svilupperà idrogeno, mentre all'anodo continuerà a svilupparsi ossigeno.
Si sarà in tal modo ottenuta l'elettrolisi dell'acqua
2H20 2H2 + O2
Si tenga presente che il fenomeno risulta sensibile solo se in soluzione esiste un elettrolita che consenta la conduzione. Se tentiamo di effettuare l'elettrolisi dell'acqua pura il passaggio di corrente sarà praticamente nullo a causa della bassissima costante di dissociazione dell'acqua, ed il processo elettrolitico assolutamente trascurabile.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Elettrolisi di una soluzione contenente più ioni precedenza di scarica tipo file : doc
Elettrolisi di una soluzione contenente più ioni precedenza di scarica
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Elettrolisi di una soluzione contenente più ioni precedenza di scarica utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Elettrolisi di una soluzione contenente più ioni precedenza di scarica
Termini d' uso e privacy