Elettroliti non elettroliti e grado di dissociazione
Elettroliti non elettroliti e grado di dissociazione
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Elettroliti non elettroliti e grado di dissociazione
Le sostanze che si sciolgono in acqua (ed in generale nei solventi polari) si dividono in elettroliti e non-elettroliti.
1. I non-elettroliti sono sostanze che sciolte in acqua non si dissociano in ioni di carica opposta. Sono esempi di non elettroliti il glucosio, l'alcool etilico, l'anidride carbonica. Il termine "non-elettrolita" fa riferimento all'impossibilità per le soluzioni che contengono questo tipo di soluti di dare il processo dell'elettrolisi.
2. Gli elettroliti sono sostanze che disciolte in acqua si dissociano, in misura più o meno elevata, in ioni di carica opposta. Il termine "elettrolita" fa riferimento al fatto che solo le soluzioni che contengono ioni di carica opposta sono in grado di dare processi elettrolitici.
Gli elettroliti si dicono "forti" quando si dissociano in modo completo. Sono elettroliti forti quasi tutti i sali, gli acidi forti (HCl, HBr, HI, HNO3 etc) e le basi forti (idrossidi dei metalli alcalini e alcalino-terrosi).
Gli elettroliti si dicono "deboli" quando sono solo parzialmente dissociati. Sono elettroliti deboli gli acidi deboli (HF, H2S, HCN HNO2 etc) e le basi deboli (gli idrossidi degli altri metalli).
Si definisce grado di dissociazione a il rapporto tra il numero di moli dissociate ed il numero di moli inizialmente presenti.
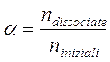
Il grado di dissociazione è evidentemente uguale a 0 per i non-elettroliti, è pari a 1 per gli elettroliti forti e assume valori compresi tra 0 ed 1 per gli elettroliti deboli.
Se una sostanza presenta ad esempio un grado di dissociazione pari a 0,3 significa che per ogni 100 molecole che sono state poste in soluzione, 30 si sono dissociate in ioni, mentre 70 sono disciolte senza essere dissociate.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Elettroliti non elettroliti e grado di dissociazione tipo file : doc
Elettroliti non elettroliti e grado di dissociazione
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Elettroliti non elettroliti e grado di dissociazione utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Elettroliti non elettroliti e grado di dissociazione
Termini d' uso e privacy