Equazione di stato dei gas perfetti
Equazione di stato dei gas perfetti
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Equazione di stato dei gas perfetti
Le tre leggi dei gas possono combinarsi in un'unica relazione in cui compaiono contemporaneamente tutte e tre le variabili di stato. L'equazione è dovuta al francese Clapeyron (1834).
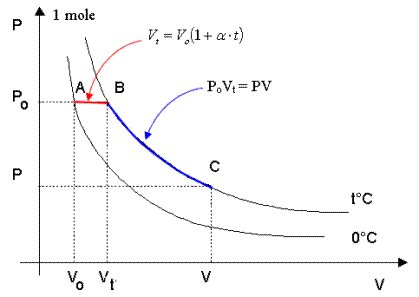
Si consideri 1 mole di un gas qualsiasi e le due isoterme di 0°C e di t°C.
Consideriamo ora i tre punti A, B e C posti sulle isoterme e le trasformazioni AàB e BàC
1) La trasformazione AàB, avvenendo a pressione Po costante è una trasformazione isobara per la quale vale la relazione Vt = Vo(1 + at)
2) la trasformazione BàC, avvenendo a temperatura t costante è una isoterma per la quale vale la relazione PV = PoVt.
sostituendo ora nella seconda il valore Vt ricavato dalla prima si ottiene
PV = PoVo(1+ at)
da cui
e quindi 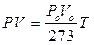
Poichè Po e Vo sono la pressione e ill volume alla temperatura costante di 0°C, il loro prodotto è, per la legge di Boyle, costante e quindi anche la quantità 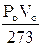 è costante.
è costante.
Ricordando che 1 mole di qualsiasi gas a 0°C e ad 1 atmosfera occupa sempre 22,414 l, se poniamo Po = 1 atm, Vo sarà appunto pari a 22,414 l ed il rapporto, noto come costante universale dei gas R, varrà
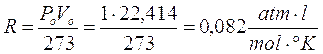
Ricordiamo che se esprimiamo la pressione in Pascal ed il volume in m3 (sistema SI) R vale
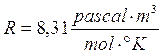 o
o
mentre nel sistema cgs R vale
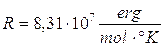
Per una mole di gas l'equazione di stato diventa dunque
PV = RT
Per n moli il volume Vo ad 1 atmosfera e 0°C non sarà evidentemente 22,414 l, ma sarà pari ad n volte 22,414 l e l'equazione diverrà
PV = nRT
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Equazione di stato dei gas perfetti tipo file : doc
Equazione di stato dei gas perfetti
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Equazione di stato dei gas perfetti utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Equazione di stato dei gas perfetti
Termini d' uso e privacy