Fenomeni elettrochimici di interesse pratico
Fenomeni elettrochimici di interesse pratico
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Fenomeni elettrochimici di interesse pratico
1) La corrosione
Qualsiasi elemento che presenti un potenziale di riduzione inferiore a quello della coppia H20/H2 può essere ossidato dall'acqua, la quale ne acquista gli elettroni riducendosi secondo la reazione
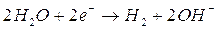 )
)
Naturalmente il potenziale di tale reazione è misurato in condizioni standard, per una concentrazione 1 M di ioni OH- (pH = 14). Calcolando il potenziale di tale reazione per un pH 7, tramite l'equazione di Nernst, si ottiene
a pH = 7 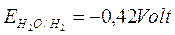
L'acqua pura a pH neutro è quindi in grado di ossidare (corrodere) tutti i metalli che presentano un potenziale inferiore a -0,42V come lo zinco ( -0,76) l'alluminio (-1,66) e tutti i metalli alcalini e alcalino-terrosi.
Il ferro, 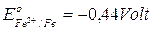 , possedendo un potenziale praticamente uguale a quello dell'acqua non viene praticamente attaccato a pH 7 ( le soluzioni acide però lo corrodono).
, possedendo un potenziale praticamente uguale a quello dell'acqua non viene praticamente attaccato a pH 7 ( le soluzioni acide però lo corrodono).
Tuttavia se l'acqua contiene ossigeno o è presente umidità nell'aria è necessario tener presente la seguente semireazione di riduzione
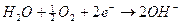 )
)
a pH 7 la coppia H20,O2/OH- presenta il seguente potenziale
a pH 7 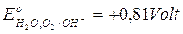
in grado quindi di ossidare non solo il ferro, ma molti altri metalli come Stagno (- 0,14 V), Piombo (- 0,13 V) e Rame (+ 0,34 V).
Si noti come aumentando l'acidità della soluzione aumenti il potenziale di riduzione sia della coppia H20/H2, che della coppia H20,O2/OH-.
Il potere corrosivo dell'acqua aumenta quindi in ambiente acido.
La corrosione del ferro ad opera dell'acqua contenente ossigeno atmosferico (arruginimento) è un fenomeno complesso e non completamente chiarito. Si ritiene che il ferro metallico venga dapprima ossidato a Fe2+ dalla coppia H20,O2/OH-. Gli ioni ferrosi che passano in soluzione vengono rapidamente ossidati a ioni ferrici quando giungono a contatto con regioni acquose a maggior tenore di ossigeno.
Non appena formatisi gli ioni ferrici producono idrossidi e carbonati insolubili (grazie alla CO2 atmosferica che si scioglie in acqua formando acido carbonico), che precipitano in un solido scaglioso di composizione non perfettamente definita noto come ruggine.
In realtà si ritiene più probabile che l'idrossido ferrico precipiti sotto forma di ossido ferrico idratato, attraverso una reazione del tipo
2Fe(OH)3 Fe2O3.3H2O
Nella ruggine l'ossido ferrico sarebbe presente con diverso grado di idratazione, pertanto si preferisce descriverlo con la formula generale Fe2O3.nH2O.
2) La passivazione
Molti altri metalli (Zinco, Rame, Alluminio etc) reagiscono all'aria umida, ma a differenza di quanto accade per il ferro, la miscela di ossidi e carbonati che si forma non è friabile, ma costituisce uno strato solido, coerente, che protegge il metallo sottostante da ulteriori fenomeni corrosivi. Tale processo è detto passivazione.
Ad esempio il rame (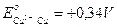 )all'aria umida viene ossidato con formazione di idrossido rameico il quale reagisce in parte con la CO2 disciolta in acqua per dare un carbonato monobasico rameico, responsabile della patina verde che ricopre il metallo esposto all'aria (verderame)
)all'aria umida viene ossidato con formazione di idrossido rameico il quale reagisce in parte con la CO2 disciolta in acqua per dare un carbonato monobasico rameico, responsabile della patina verde che ricopre il metallo esposto all'aria (verderame)
Cu(OH)2 + H2CO3 [Cu(OH)]2CO3 + 2 H2O
Lo zinco si comporta in modo analogo formando sulla sua superficie uno strato passivante costituito da ossido ZnO e carbonato basico [Zn(OH)]2CO3.
La passivazione dell'alluminio può essere addirittura effettuata artificialmente, ottenendo uno strato di ossido più spesso, utilizzando il metallo come anodo in una cella elettrolitica. In tal modo lo strato superficiale del metallo si ossida e si ottiene l'alluminio anodizzato.
3) Prevenzione della corrosione
Per proteggere il ferro dalla corrosione (si calcola che circa il 20% della produzione annua mondiale di ferro venga utilizzata per sostituire il metallo arrugginito) è necessario impedire che la coppia H20,O2/OH- sia in grado di esercitare i suoi effetti.
Una soluzione semplice è quella di verniciare il ferro con una vernice antiruggine contenente sostanze chimiche, come il minio Pb3O4, il quale, avendo un potenziale normale di +1,45 Volts, non può essere ossidato dall'aria umida.
Naturalmente le vernici antiruggine rappresentano una soluzione per piccole strutture metalliche e comunque di non lunga durata, non essendo in grado di aderire permanentemente alla superficie metallica.
Una soluzione più duratura è quella di rivestire il ferro con uno strato sottile di un metallo con potenziale di riduzione più basso del ferro stesso, ma in grado di subire il fenomeno della passivazione come ad esempio lo zinco.
Il ferro zincato viene egregiamente protetto dalla corrosione, sia perchè in superficie si forma uno strato inerte di ossidi e carbonati di zinco, sia perchè, anche se lo strato di zinco viene scalfito ed il ferro esposto agli agenti atmosferici, lo zinco ne previene ulteriormente la corrosione ossidandosi al posto del ferro (presenta infatti un potenziale minore).
La zincatura può essere effettuata immergendo il ferro nello zinco fuso (automobili) o usando l'oggetto da zincare come catodo in una cella elettrolitica contenente un sale di zinco (galvanizzazione)
Non così accadeva con il ferro stagnato (latta) in quanto lo stagno presenta un potenziale di riduzione (-0,14 V) più elevato del ferro. Una volta scalfita la superficie stagnata il ferro arruginisce.
Per lo stesso motivo non si dovrebbero fissare oggetti di rame (ad esempio grondaie) con chiodi di ferro, in quanto il rame presenta un potenziale superiore al ferro e tende quindi ad ossidarlo rapidamente (in presenza di una soluzione elettrolitica come può essere l'umidità atmosferica che si condensa sulle superfici metalliche).
Naturalmente non è possibile zincare strutture metalliche di grandi dimensioni come navi o ponti. In tal caso è sufficiente collegare la struttura ad una placca di metallo a potenziale minore, detto anodo sacrificale (in genere Zinco o Magnesio) che si ossida al posto del ferro. Naturalmente tali placche vanno periodicamente sostituite.
4) Galvanoplastica
Il processo di galvanizzazione, che abbiamo visto essere utilizzato per zincare e proteggere il ferro dalla corrosione, può essere utilizzato anche per ricoprire (placcare) oggetti anche con metalli diverse, sia per protezione che a scopi decorativi.
Se ad esempio vogliamo argentare un oggetto di ferro è sufficiente utilizzarlo come catodo in una cella elettrolitica contenente un sale di argento (ad esempio AgNO3), mentre all'anodo useremo un elettrodo di argento metallico. In tal modo l'argento metallico si ossida passando in soluzione come Ag+, mentre al catodo gli ioni Ag+ si depositano come argento metallico.
In modo analogo si possono eseguire altre placcature elettrolitiche come dorature, nichelature, cromature etc.
Quando l'oggetto da rivestire non è un conduttore lo si può rendere tale ricoprendolo con una vernice conduttrice (ad esempio polvere di grafite).
Quando l'operazione viene eseguita rendendo conduttrice la parte interna di uno stampo è possibile far depositare il metallo all'interno dello stesso ottenendo in tal modo oggetti metalli per via elettrolitica.
6) Raffinazione elettrolitica dei metalli
Con un processo analogo alla placcatura elettrolitica è possibile procedere alla raffinazione dei metalli. Se infatti in una soluzione elettrolitica che contenga un sale del metallo da raffinare, usiamo come anodo il metallo grezzo da raffinare e come catodo una lamina dello stesso metallo allo stato puro, il processo elettrolitico porterà in soluzione l'anodo ossidandolo, mentre depositerà al catodo metallo puro riducendo gli ioni metallici in soluzione.
Ad esempio per la raffinazione elettrolitica del rame si immergono gli elettrodi di rame (l'anodo impuro, il catodo puro) in una soluzione di solfato rameico e acido solforico.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Fenomeni elettrochimici di interesse pratico tipo file : doc
Fenomeni elettrochimici di interesse pratico
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Fenomeni elettrochimici di interesse pratico utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Fenomeni elettrochimici di interesse pratico
Termini d' uso e privacy