I modelli atomici di Thomson e Rutherford
I modelli atomici di Thomson e Rutherford
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
I modelli atomici di Thomson e Rutherford
Agli inizi del '900 vi erano dunque sufficienti elementi per formulare un modello atomico coerente. Nel 1904 J.J. Thomson ipotizzò che gli atomi fossero costituiti da una massa carica positivamente, uniformemente distribuita, all'interno della quale erano presenti gli elettroni, carichi negativamente, in numero tale da determinare l'equilibrio delle cariche e quindi la neutralità.
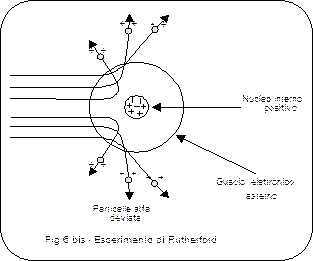
Per cercare di chiarire la reale distribuzione delle cariche positive e negative che costituiscono l’atomo è possibile studiare gli effetti di deflessione (scattering o diffusione) che queste producono su particelle-proiettile dotate di carica. Tale tecnica, oggi divenuta molto comune per sondare la struttura della materia, fu utilizzata per la prima volta proprio sull’atomo, utilizzando come proiettili particelle a e b.
Nel 1911 Rutherford, a conclusione di una serie di esperimenti di scattering condotti sugli atomi, giunse a modificare profondamente il modello di Thomson
In tali esperimenti vennero fatte collidere particelle a con sottilissimi fogli metallici di oro o platino.
Il loro comportamento risultò sorprendente ed incompatibile con il modello di Thomson: la maggior parte delle particelle attraversava indisturbata il diaframma metallico proseguendo in linea retta, ma alcune particelle subivano vistose deflessioni, in alcuni casi rimbalzando addirittura indietro. Il numero delle particelle deviate risultava correlato al numero atomico degli atomi bombardati.
L’esperienza suggerisce che:
- La struttura atomica sia estremamente rarefatta, visto l’alto numero di particelle in grado di attraversarla
- la diffusione sia provocata dalla repulsione tra particelle alfa incidenti ed una carica positiva estremamente concentrata il cui valore cresca al crescere del numero atomico.
|
Infatti se la carica positiva fosse diffusa, distribuita uniformemente su tutto il volume atomico, le particelle a sarebbero sottoposte sempre ad una forza risultante nulla o quasi nulla, sia passando all’interno di un atomo, sia passando tra gli atomi (è quel che accade utilizzando come proiettili-sonda gli elettroni, i quali attraversano la materia subendo deviazioni molto piccole, a causa della distribuzione più omogenea e diffusa delle cariche negative dell’atomo).
Per giustificare i risultati dei suoi esperimenti, Rutherford propose dunque un nuovo modello atomico, detto modello planetario con gli elettroni che andavano a costituire una specie di corteccia esterna al massiccio nucleo positivo, in modo da garantire la neutralità a livello macroscopico. Per non cadere nel nucleo, attirati dalla carica positiva in esso presente, gli elettroni negativi dovevano naturalmente possedere un'energia cinetica agente in senso opposto.
Da calcoli effettuati sulle percentuali e sugli angoli di deviazione, Rutherford giunse a calcolare che, mentre l'atomo doveva possedere un diametro dell'ordine di 10-8 cm, il nucleo avrebbe dovuto presentare un diametro dell'ordine di 10-12 -10-13 cm.
Lo stesso Rutherford proporrà in seguito di chiamare protone il nucleo dell’elemento più leggero, l’idrogeno. L'esistenza dei protoni venne definitivamente confermata nel 1925 da Blackett, il quale riuscì ad ottenere immagini fotografiche (camera di Wilson) della trasmutazione dell'azoto,
che, colpito da una particella si trasforma in un nucleo di ossigeno e libera un protone del suo nucleo.
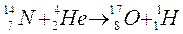
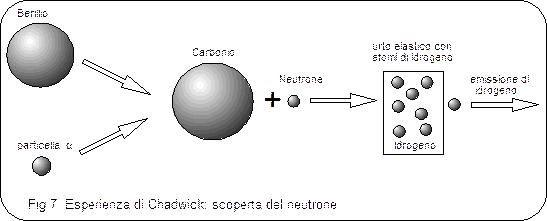
Solo molto più tardi (1932) James Chadwick, bombardando il Berillio con particelle a, scoprì che nei nuclei sono presenti anche particelle neutre, aventi una massa dello stesso ordine di grandezza del protone, anche se leggermente superiore, che vennero chiamati neutroni .
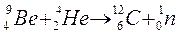
La scoperta dei neutroni permise di giustificare completamente l'esistenza degli isotopi, scoperti in precedenza da Thomson. Inoltre permise di classificare gli atomi dei vari elementi in funzione del numero dei protoni presenti nel loro nucleo.
Il modello di Rutherford presentava tuttavia gravi difetti in quanto gli elettroni che ruotano intorno al nucleo dovrebbero perdere energia cinetica sotto forma di emissione di radiazione elettromagnetica, come previsto dalle leggi dell’elettrodinamica, finendo per cadere sul nucleo. Inoltre gli atomi, in opportune condizioni, sono in grado di emettere e assorbire radiazione elettromagnetica secondo modalità che il modello planetario di Rutherford non era in grado di giustificare.
Fu pertanto necessario introdurre un nuovo modello atomico. Ma prima di parlarne è necessario affrontare, sia pur brevemente, il problema della natura della radiazione elettromagnetica e dei fenomeni di interazione che essa manifesta con la materia.Bombardando il Berillio con particelle alfa esso emetteva una radiazione invisibile, che non veniva in alcun modo deflessa da campi magnetici o elettrici, il cui unico effetto era di provocare l'emissione da parte di nuclei di Azoto, contro cui era diretta, di protoni. Applicando semplicemente il principio di conservazione dell'energia e della quantità di moto e supponendo elastici gli urti tra le particelle, Chadwick fu in grado di calcolare la massa dei neutroni
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : I modelli atomici di Thomson e Rutherford tipo file : doc
I modelli atomici di Thomson e Rutherford
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come I modelli atomici di Thomson e Rutherford utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
I modelli atomici di Thomson e Rutherford
Termini d' uso e privacy