Idrolisi acida
Idrolisi acida
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Idrolisi acida
a) sale derivato da acido forte e base debole
Si produce un'idrolisi acida quando viene sciolto in acqua un sale il cui anione deriva da un acido forte, mentre il catione deriva da una base debole.
Prendiamo ad esempio il cloruro di ammonio NH4Cl che deriva dall'acido cloridrico HCl (acido forte con ka elevata) e dall'idrossido di ammonio NH4OH (base debole con kb bassa).
In soluzione acquosa il cloruro di ammonio è, come la maggior parte dei sali, completamente dissociato in ioni NH4+ e ioni Cl-
NH4Cl NH4+ + Cl-
E' necessario ora analizzare in che modo tali ioni interferiscano con l'equilibrio di dissociazione dell'acqua.
Mentre lo ione cloruro Cl- , derivando da un acido forte, non ha alcuna tendenza a riassociarsi con gli ioni H+, lo ione ammonio NH4+ tende a rubare ioni OH- per ridare la base debole NH4OH.
Come al solito, per determinare le concentrazioni di equilibrio delle specie chimiche sarebbe necessario tener conto simultaneamente dei due equilibri che interferiscono: quello di dissociazione dell'acqua e quello di dissociazione della base debole
H2O H+ + OH-
NH4OH NH4+ + OH-
Se la concentrazione iniziale del sale è sufficientemente elevata è comunque possibile, come per l'idrolisi basica, ricorrere ad una descrizione semplificata del fenomeno, scrivendo il seguente equilibrio di idrolisi
NH4+ + H2O NH4OH + H+
la cui costante di equilibrio vale naturalmente
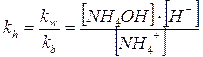
Tale relazione mette in evidenza come l'equilibrio di idrolisi acida è tanto più spostato verso destra quanto più la base è debole (maggiore tendenza ad associarsi liberando ioni H+). Di conseguenza la soluzione risulterà essere tanto più acida quanto più piccolo è il valore della kb (e più elevato il valore della kh).
b) sale derivato da acido forte e da un catione di un metallo di transizione
I cationi dei metalli di transizione formano in soluzione degli ioni idratati (composti di coordinazione) che si comportano come acidi. Le soluzioni di tali sali sono tutte più o meno acide ed il processo che avviene è analogo a quello descritto per l'idrolisi acida. In tal caso però il valore della costante di idrolisi viene espresso come ka dello ione idratato.
Ad esempio le soluzioni di cloruro ferrico FeCl3 sono molto acide. Potremmo descrivere il fenomeno dicendo che mentre lo ione cloruro Cl- non si riassocia per dare l'acido cloridrico forte, lo ione ferrico Fe3+ da luogo al seguente equilibrio di idrolisi
Fe3+ + H2O FeOH2+ + H+
Tale reazione viene però comunemente indicata come dissociazione acida dello ione ferrico e la costante di reazione è nota come ka e non come kh.
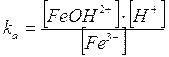
In realtà la reazione reale non coinvolge lo ione ferrico, ma lo ione idratato e questo vale per la maggior parte dei cationi metallici con proprietà acide.
Fe(H2O)63+ [Fe(OH)(H2O)5]2+ + H+
Lo ione complesso esaacquoferrico si comporta come un acido dissociandosi in uno ione H+ e in uno ione complesso pentaacquo-idrossi-ferrico, responsabile quest'ultimo della comune colorazione verde-giallastro delle soluzioni dei sali ferrici (lo ione esaacquoferrico ha una colorazione porpora chiaro).
I due equilibri precedenti sono comunque equivalenti.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Idrolisi acida tipo file : doc
Idrolisi acida
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Idrolisi acida utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Idrolisi acida
Termini d' uso e privacy