Idrolisi di un sale derivante da un acido debole e da una base debole
Idrolisi di un sale derivante da un acido debole e da una base debole
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Idrolisi di un sale derivante da un acido debole e da una base debole
In tal caso, dopo che il sale si è dissociato in acqua, sia il catione che l'anione prodotti tendono a riformare, naturalmente in misura diversa, la base debole e l'acido debole da cui provengono. Il pH della soluzione sarà naturalmente acido se kb < ka, mentre sarà basico in caso contrario.
Prendiamo ad esempio il cianuro di ammonio NH4CN, che deriva dall'idrossido di ammonio NH4OH (base debole, kb = 1,8.10-5) e dall'acido cianidrico HCN (acido debole, ka = 4,9.10-10).
Per calcolare il pH di tale soluzione sarebbe necessario tener conto simultaneamente dei seguenti tre equilibri
1) H2O H+ + OH-
2) NH4OH NH4+ + OH-
3) HCN H+ + CN-
Poiché la costante di dissociazione dell'acido cianidrico è inferiore di quella dell'ammoniaca (ka < kb) possiamo prevedere che l'acido cianidrico si riassoci in percentuale maggiore rispetto all'idrossido di ammonio (il 3° equilibrio risulta cioè più spostato verso sinistra rispetto al 2°). La soluzione sarà pertanto basica.
La soluzione esatta del problema richiederebbe naturalmente la risoluzione di un sistema di equazioni in cui compaiano tutte le condizioni relative ai tre equilibri.
La risoluzione approssimata prende invece in considerazione il seguente equilibrio di idrolisi
NH4+ + CN- + H2O NH4OH + HCN
secondo il quale per ogni ione OH- che si riassocia con uno ione NH4+, uno ione H+ si riassocia con uno ione CN-.
Si può facilmente dimostrare che la costante di tale equilibrio vale
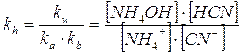
Tenendo presente che le concentrazioni iniziali di NH4+ e di CN- sono pari alla concentrazione del sale completamente dissociato, sarà quindi possibile calcolare le concentrazioni di equilibrio delle quattro specie chimiche. Queste ultime, sostituite nella relazioni di equilibrio dell'acido e della base derivate dalla 2) e dalla 3), forniranno le concentrazioni approssimate degli ioni H+ e OH-.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Idrolisi di un sale derivante da un acido debole e da una base debole tipo file : doc
Idrolisi di un sale derivante da un acido debole e da una base debole
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Idrolisi di un sale derivante da un acido debole e da una base debole utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Idrolisi di un sale derivante da un acido debole e da una base debole
Termini d' uso e privacy