Il legame covalente puro o omopolare
Il legame covalente puro o omopolare
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Il legame covalente puro o omopolare
Si tratta di un legame che si stabilisce tra due o più atomi di uno stesso elemento non metallico. E' tipico di molecole come quella dell'idrogeno gassoso (H2), dell'ossigeno gassoso (O2), del cloro gassoso (Cl2), dell'azoto gassoso (N2) etc
La natura del legame covalente venne suggerita per la prima volta da G. Lewis, dell'università della California nel 1916. Fu Lewis che per primo attribuì l'inerzia chimica dei gas nobili al fatto di possedere 8 elettroni superficiali e avanzò quindi l'ipotesi che gli altri elementi che non presentavano la stessa configurazione elettronica esterna tendessero a raggiungerla mediante legami chimici.
Prendiamo ad esempio due atomi di cloro, rappresentandoli mediante la loro configurazione di Lewis

Essi hanno entrambi una configurazione 3s2 3p5, con un elettrone spaiato sull'ultimo orbitale p ed una forte tendenza ad acquistare un ulteriore elettrone (elevata affinità elettronica) per raggiungere la configurazione stabile del gas nobile successivo ( l'argon).
Possiamo pensare che entrambi i nuclei attirino fortemente l'elettrone spaiato dell'altro atomo senza peraltro riuscire a strapparlo.
Il risultato di questa intensa attrazione incrociata è che i due elettroni spaiati vengono alla fine condivisi da entrambi gli atomi ed il doppietto elettronico funge da legame, finendo per appartenere ad entrambi gli atomi.
In questo modo ciascun atomo "vede" intorno a sè 8 elettroni raggiungendo la configurazione stabile dell'ottetto. Il legame che si forma per condivisione di una coppia di elettroni da parte di due atomi di uno stesso elemento è detto legame covalente semplice e può essere rappresentato mediante una barretta che unisce i due simboli chimici.
Cl - Cl
Si può dimostrare che quando i due atomi si avvicinano in risposta all'attrazione che ciascun nucleo esercita sull'elettrone spaiato dell'altro atomo, esiste una distanza critica in corrispondenza della quale la forza di attrazione viene esattamente bilanciata dalla repulsione che si produce tra i gusci elettronici negativi.
Per distanze inferiori prevale la repulsione, per distanze maggiori prevale l'attrazione.
In corrispondenza di tale distanza viene quindi resa minima l'energia potenziale del sistema, come si può osservare nel grafico sottostante.
Tale distanza corrisponde alla lunghezza di legame, parametro solitamente misurato in angström
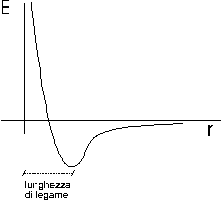
L'energia che si libera per effetto dell'aumento di stabilità, misurata in Kcal/mol, è detta forza di legame e coincide con l'energia che è necessario fornire alla molecola per rompere lo stesso legame.
Oggi il legame covalente viene descritto in modo più preciso attraverso la meccanica quantistica. Secondo tale teoria due atomi aventi ciascuno un orbitale con un elettrone spaiato possono avvicinarsi al punto di sovrapporre i due orbitali. La sovrapposizione produce un nuovo orbitale, detto orbitale di legame, la cui forma e la cui energia possono essere calcolate tramite la somma delle funzioni d'onda degli orbitali che si sovrappongono.
Il nuovo orbitale che si forma contiene due elettroni con spin antiparallelo ed appartiene ad entrambi gli atomi. E' cioè un orbitale molecolare.
Nel caso di un legame semplice come quello descritto per la molecola del cloro gassoso, gli orbitali atomici che si sovrappongono sono due orbitali p. Essi tendono a sovrapporsi lungo l'asse maggiore in modo da rendere massima la sovrapposizione. Questo tipo di sovrapposizione produce un legame particolarmente stabile detto legame .

Nella formazione di un legame covalente possono essere condivise anche più di una coppia di elettroni.
E' il caso ad esempio delle molecole dell'ossigeno e dell'azoto.
L'ossigeno presenta 6 elettroni nell'ultimo livello con una configurazione elettronica superficiale 2s2 2p4, con due elettroni spaiati su due orbitali p. Per completare l'ottetto ciascun atomo di ossigeno deve dunque condividere 2 elettroni

Il legame che si forma è un legame covalente puro doppio che può essere rappresentato con due barrette poste tra i simboli chimici dei due atomi
O = O
In questo caso si formano però due orbitali di legame di tipo diverso. Infatti supponendo che il primo orbitale di legame derivi dalla sovrapposizione lungo l'asse maggiore di due orbitali atomici pz con formazione di un legame di tipo sigma, l'altro legame deve prodursi per sovrapposizione di due orbitali atomici pY o pX, i quali risultano disposti perpendicolarmente all'orbitale pz.
La sovrapposizione non avverrà quindi per il secondo legame lungo l'asse maggiore, ma i due orbitali si sovrapporranno lateralmente, lungo l'asse minore. Tale legame è detto di tipo p e risulta essere meno forte di un legame di tipo sigma in cui vi è una migliore sovrapposizione.
La forza di un doppio legame risulta quindi complessivamente maggiore di quella di un legame semplice anche se non raggiunge due volte l'intensità di un legame semplice.
Un doppio legame risulta essere inoltre anche più breve di un legame semplice.
Nel caso dell'azoto la configurazione elettronica superficiale è del tipo 2s2 2p3, con tre elettroni spaiati su due orbitali p. Per completare l'ottetto ciascun atomo di ossigeno deve dunque condividere 3 elettroni

Il legame che si forma è un legame covalente puro triplo che può essere rappresentato con tre barrette poste tra i simboli chimici dei due atomi
N N
In questo caso si formano un orbitale di legame di tipo e due orbitali di legame di tipo p.
Naturalmente un triplo legame risulta essere più forte e più breve di un legame doppio.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Il legame covalente puro o omopolare tipo file : doc
Il legame covalente puro o omopolare
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Il legame covalente puro o omopolare utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Il legame covalente puro o omopolare
Termini d' uso e privacy