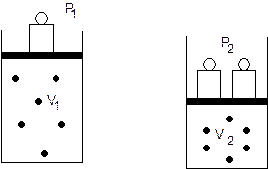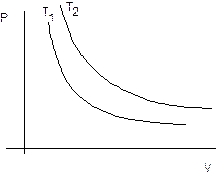Legge di Boyle
Legge di Boyle
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Legge di Boyle
STATO GASSOSO
Lo stato di aggregazione di una sostanza, solido, liquido o aeriforme, dipende, oltre che dal tipo e dall'intensità delle forze intermolecolari, dai valori che assumono la pressione P, la temperatura T ed il volume V. Per questo motivo tali grandezze sono dette variabili di stato.
Nello stato gassoso le distanze tra le molecole risultano molto elevate, poichè le particelle possiedono energia cinetica sufficiente a vincere le forze di attrazione intermolecolari e sono perciò in grado di separarsi. Il moto caotico delle particelle allo stato gassoso determina il fenomeno della diffusione, per il quale un gas occupa sempre tutto lo spazio a sua disposizione e presenta per questo motivo forma e volume del recipiente che lo contiene.
Il Volume è definito come la porzione di spazio occupata da un corpo. Esso viene misurato in m3 ed in chimica, più spesso in litri (l).
La Temperatura misura la capacità di un corpo di dare sensazioni di caldo e freddo. Più precisamente essa è una misura dell'energia cinetica media delle particelle che costituiscono un corpo.
La temperatura si misura in
1) gradi centigradi o Celsius (°C)
2) gradi assoluti o Kelvin (°K)
3) gradi Fahreneit (°F).
La scala Celsius (t) è convenzionalmente costruita assegnando al ghiaccio fondente la temperatura di 0 °C e all'acqua bollente la temperatura di 100 °C.
La scala delle temperature assolute (T) è costruita partendo dalla costatazione che la più bassa temperatura Celsius corrisponde a -273,15°C. Pochè non sono possibili temperature inferiori, tale valore rappresenta lo zero assoluto delle temperature.
La scala delle temperature assolute si ottiene quindi traslando l'origine della scala Celsius dagli 0°C a -273,15°C.
E' evidente quindi che per trasformare i gradi Celsius in gradi Kelvin è sufficiente utilizzare la seguente relazione di conversione
T = t + 273,15
Così, ad esempio, lo zero della scala Celsius corrisponde a 273,15 °K, mentre l'acqua bolle a 373,15 °K.
Nella scala Fahreneit al ghiaccio fondente è assegnata convenzionalmente una temperatura di 32 °F, mentre all'acqua bollente è assegnata convezionalmente la temperatura di 212 °F . A differenza della scala centigrada dunque, dove tale intervallo è diviso in 100 gradi, nella scala Fahreneit è suddiviso in 180 gradi. Un grado Fahreneit risulta perciò più piccolo di un grado centigrado. |
La temperatura determina la direzione del flusso di calore.
La Pressione si definisce come il rapporto tra una forza e la superficie sulla quale la forza agisce.
Le unità di misura della pressione sono molteplici. Le più utilizzate sono
a) Chilogrammo su centimetro quadrato (Kg/cm2)
b) Atmosfera (atm). E' definita come la pressione esercitata dall'atmosfera terrestre sul livello del mare (slm), a 0°C, a 45° N, con un'umidità relativa pari allo 0% .
1 atm = 760 mm di Hg ( o torr) = 1,033 kg/cm2
c) Pascal (Pa). Nel Sistema Internazionale SI è la forza esercitata da 1 N (newton) sulla superficie di m2. ( 1 newton è la forza che, applicata alla massa di 1 Kg produce un'accelerazione di 1 m/s2).
d) Bar. Nel sistema cgs è la forza esercitata da 106 dine su 1 cm2. ( 1 dina è la forza che, applicata alla massa di 1 g produce un'accelerazione di 1 cm/s2).
1 atm = 1,013 Bar = 101.300 Pascal
Si definiscono condizioni normali (c.n.) o standard di temperatura e pressione (STP), la temperatura di 0 °C e la pressione di 1 atm.
LE LEGGI DEI GAS
Le ricerche sperimentali effettuate sullo stato aeriforme (a partire dai lavori di Robert Boyle verso la metà del Seicento) hanno dimostrato che se un gas è sufficientemente rarefatto e/o possiede una temperatura sufficientemente elevata, il suo comportamento fisico risulta indipendente dalla sua natura chimica. In altre parole, tutti i gas che si trovano sufficientemente distanti dal loro punto di liquefazione si comportano allo stesso modo e possono essere descritti mediante un unico formalismo matematico.
E' cioè possibile trattare le particelle che compongono il gas (molecole o atomi che siano) come punti materiali le cui interazioni dipendono esclusivamente dal loro numero per unità di volume e dalla loro energia cinetica media, trascurando le forze intermolecolari che dipendono evidentemente dalla loro natura chimica.
Tale approccio verrà in effetti completamente sviluppato e formalizzato solo nella seconda metà dell'Ottocento con la Meccanica statistica, attraverso la teoria cinetico- molecolare dei gas.
E' comunque possibile descrivere il comportamento fisico dei gas senza ricorrere ad una descrizione della dinamica delle interazioni molecolari, limitandosi a formulare le relazioni che legano le variabili macroscopiche o variabili di stato: pressione, volume e temperatura.
Tali relazioni sono note come leggi dei gas perfetti.
Un gas perfetto è un gas ideale in cui gli urti delle particelle sono perfettamente elastici, ciascuna particella non occupa virtualmente volume (particella puntiforme) e non vi sono forze intermolecolari che vincolino in alcun modo il moto delle molecole. E' evidente che un gas perfetto in realtà non esiste, si tratta solo di un'utile astrazione. Ma in opportune condizioni di rarefazione i gas reali possono avvicinarsi in modo accettabile a tale modello ideale.
Le leggi dei gas perfetti sono 4. Le prime tre sono state ottenute mantenendo costante una delle tre variabili di stato ed osservando sperimentalmente la relazione esistente nelle variazioni delle due rimanenti. La quarta legge mette invece in relazione contemporaneamente tutte e tre le variabili di stato in un'unica equazione.
Legge di Boyle
(relazione tra P e V con Tcostante)
Nel 1662 Boyle dimostrò che mantenendo costante la temperatura il volume di una data massa di gas è inversamente proporzionale alla pressione esercitata su di esso.
|
P1.V1 = P2.V2 = K
ed in definitiva
PV = K
La curva che si ottiene ponendo in ascisse il volume ed in ordinata la temperatura è naturalmente un ramo di iperbole equilatera detta isoterma.
|
Naturalmente effettuando l'esperimento a diverse temperature si ottengono diverse isoterme. Aumentando la temperatura l'isoterma si sposta verso l'esterno Nell'esempio in figura T2 > T1.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Legge di Boyle tipo file : doc
Legge di Boyle
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Legge di Boyle utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Legge di Boyle
Termini d' uso e privacy