Legge di Dalton o delle pressioni parziali
Legge di Dalton o delle pressioni parziali
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Legge di Dalton o delle pressioni parziali
Quando due o più gas vengono mescolati in un recipiente, senza che tra essi avvenga alcuna reazione, la pressione totale esercitata dalla miscela gassosa è uguale alla somma delle pressioni che ciascun componente la miscela eserciterebbe se occupasse da solo tutto il recipiente (pressione parziale del componente).
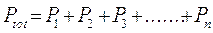
La pressione parziale di un generico componente imo sarà pari a
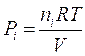
Ciascun componente gassoso si comporta dunque come fosse da solo e contribuisce alla pressione totale in proporzione al suo numero di moli.
Se in un recipiente vi sono n1 moli del gas 1, n2 moli del gas 2,.....nn moli del gas n, l'effetto complessivo sarà equivalente alla presenza di n1+ n2 +......+ nn= n moli di un unico gas nel recipiente.
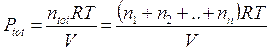
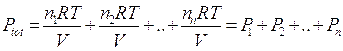
Dividendo membro a membro l'equazione di stato di ciascun componente per l'equazione di stato della miscela si ottiene
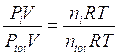
dalla quale si ricava la seguente relazione alternativa per la legge di Dalton, valida per un generico componente imo
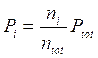
dove il rapporto 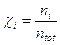 è detto frazione molare del componente imo.
è detto frazione molare del componente imo.
La legge di Dalton si esprime quindi anche dicendo che "la pressione parziale di un componente gassoso è pari al prodotto tra la sua frazione molare e la pressione totale della miscela".
Si noti che la somma di tutte le frazioni molari deve sempre necessariamente essere pari all'unità.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Legge di Dalton o delle pressioni parziali tipo file : doc
Legge di Dalton o delle pressioni parziali
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Legge di Dalton o delle pressioni parziali utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Legge di Dalton o delle pressioni parziali
Termini d' uso e privacy