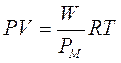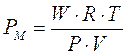Legge di Graham
Legge di Graham
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Legge di Graham
La velocità con cui un gas fuoriesce da un foro di piccole dimensioni è inversamente proporzionale alla radice quadrata del suo peso molecolare.
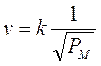
Essendo la velocità inversamente proporzionale al tempo impiegato dal gas per uscire, la legge di Graham può essere data, in forma equivalente, affermando che il tempo impiegato da un gas per diffondere attraverso un foro di piccole dimensioni è direttamente proporzionale alla radice quadrata del suo peso molecolare.
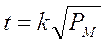
In tal modo, misurando il tempo impiegato da gas diversi per diffondere, è possibile, conoscendo il peso molecolare di uno dei due gas, calcolare il peso molecolare incognito del secondo gas
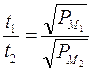
In passato tale tecnica è stata spesso usata per misurare il peso molecolare di composti volatili. Sapendo ad esempio che l’ossigeno impiega 4 volte più tempo dell’idrogeno ad uscire, se ne deduce che una molecola di Ossigeno pesa 16 volte più di una molecola di Idrogeno
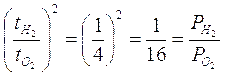
Oggi esistono gli spettrometri di massa, di gran lunga più precisi.
Un altro metodo per misurare il peso molare di un composto volatile sfrutta l'equazione di stato dei gas perfetti. Ricordando infatti che il numero di moli è pari al rapporto tra il peso in grammi (W) ed il peso molare (PM), possiamo scrivere e quindi
Al secondo membro si trova la costante R di cui conosciamo il valore e 4 variabili facilmente misurabili |
La legge di Graham fu ottenuta sperimentalmente, ma essa è facilmente derivabile per via teorica dalla teoria cinetica dei gas.
La velocità media delle particelle che costituiscono un gas alla temperatura T è infatti pari
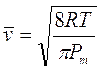
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Legge di Graham tipo file : doc
Legge di Graham
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Legge di Graham utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Legge di Graham
Termini d' uso e privacy