Numero quantico di spin e principio di esclusione di Pauli
Numero quantico di spin e principio di esclusione di Pauli
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Numero quantico di spin e principio di esclusione di Pauli
Il modello di Bohr-Sommerfeld rimane sostanzialmente invariato anche per atomi con maggior numero di protoni nel nucleo e quindi di elettroni in orbita intorno ad esso. L'unica differenza è in pratica dovuta al fatto che la maggior attrazione esercitata dal nucleo fa diminuire il diametro di tutte le orbite permesse. Il fatto permette di spiegare in modo naturale la diversità degli spettri dei vari elementi, in quanto essendo le orbite via via più compresse anche i salti quantici tra un'orbita e l'altra risultano di differente entità, producendo quindi righe spettrali peculiari.
Vi era tuttavia un problema in quanto per la fisica classica un sistema meccanico è stabile quando possiede il minor contenuto energetico. Pertanto tutti gli elettroni che vengono introdotti nelle orbite dopo il primo, dovrebbero naturalmente liberarsi della loro energia addizionale attraverso una serie di transizioni verso il primi livello energetico. Gli elettroni degli atomi pesanti dovrebbero perciò in definitiva trovarsi addensati tutti sulla prima orbita.
Poiché però tale orbita diventa sempre più piccola per l'attrazione esercitata dai nuclei via via più carichi positivamente, gli elementi più pesanti dovrebbero presentare atomi con diametro via via minore, mentre l'esperienza dimostra che ciò non è vero.
Nel 1925 il fisico tedesco Wolfgang Pauli formulò il principio noto come principio di esclusione, che permise di descrivere correttamente la distribuzione degli elettroni nelle diverse orbite.
Il principio di esclusione di Pauli afferma che ogni orbita quantica non può contenere più di due elettroni, i quali si differenziano per il valore di un quarto numero quantico detto numero quantico di spin. Il numero di spin può assumere solo i valori +1/2 e -1/2.
Con una formulazione alternativa, ma equivalente diremo
Il principio di esclusione di Pauli afferma che in un atomo non possono esistere 2 elettroni con tutti e quattro i numeri quantici uguali.
In altre parole ogni combinazione particolare dei quattro numeri quantici individua uno ed uno solo elettrone.
Ciò ha una conseguenza importante sulle configurazioni elettroniche, in quanto se entrambi i posti disponibili in un orbita sono occupati, gli elettroni successivi devono prendere posto necessariamente in orbite più esterne, sempre due per orbita.
Nel novembre del 1925 G.E. Uhlenbeck e S.A. Goudsmit diedero significato fisico al numero quantico di spin, ipotizzando l'esistenza di un momento magnetico intrinseco dell'elettrone. In altre parole è possibile immaginare l'elettrone carico negativamente come una piccola trottola che gira intorno al suo asse, in modo da produrre il momento magnetico osservato.
L’elettrone possiede un momento magnetico pari ad un magnetone di Bohr. Anche il momento magnetico intrinseco dell'elettrone risultò quantizzato. Sottoposto ad un campo magnetico esterno esso si può infatti orientare solo in due direzioni, parallele e controverse.
Allo stesso modo, anche il momento angolare intrinseco o spin dell'elettrone, il cui valore può essere determinato in funzione del momento magnetico misurato (pari ad un magnetone di Bohr) e risulta essere pari a 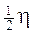 , viene ad essere quantizzato. Dunque, in accordo con il principio di Pauli, in ogni orbita possono coesistere al massimo due elettroni i quali si distinguono per avere i vettori spin ad essi associati paralleli, ma orientati in senso opposto: essi sono cioè controversi o, come si usa impropriamente dire, antiparalleli.
, viene ad essere quantizzato. Dunque, in accordo con il principio di Pauli, in ogni orbita possono coesistere al massimo due elettroni i quali si distinguono per avere i vettori spin ad essi associati paralleli, ma orientati in senso opposto: essi sono cioè controversi o, come si usa impropriamente dire, antiparalleli.
Poiché il vettore spin si considera parallelo alla direzione di avanzamento dell’elettrone, i due elettroni presenteranno:
- uno una rotazione destrorsa, alla quale si associa numero di spin
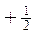
- l’altro una rotazione sinistrorsa, alla quale si associa numero di spin
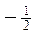
La scoperta dello spin dell'elettrone consentì di spiegare i risultati dell'esperimento di Stern-Gerlach. Gli atomi di argento possiedono infatti un numero dispari di elettroni ( Z = 47 ). Gli spin dei primi 46 elettroni si annullano a coppie, mentre lo spin dell'ultimo elettrone rimane come momento magnetico netto dell'intero atomo. In tal modo gli atomi che possiedono spin +1/2 vengono deflessi in una direzione, quelli che possiedono spin -1/2 in direzione opposta.
Nel 1926 Fermi fece una delle più feconde applicazioni del principio di esclusione, incorporandolo nella meccanica statistica ed ottenendo una nuova statistica, alternativa a quella già proposta da Bose e Einstein.
La formulazione del principio di esclusione e della statistica di Fermi che da esso deriva su basi rigorosamente quantistiche fu fatta da Dirac intorno al 1928. Tale statistica prende oggi il nome di statistica di Fermi-Dirac.
Solo nel 1940 Pauli scoprì un semplice criterio per determinare quali particelle obbediscono alla statistica di Bose-Einstein e quali alla statistica di Fermi-Dirac.
- Le particelle con spin intero sono descritte dalla statistica di Bose-Einstein e sono per questo dette bosoni. Esse non obbediscono al principio di esclusione di Pauli e possono presentarsi pertanto in numero qualsiasi nello stesso stato quantico, addensandosi numerose in uno stesso livello energetico.
- Le particelle con spin semidispari (semintero) sono descritte dalla statistica di Fermi-Dirac e sono perciò dette fermioni. Esse obbediscono al principio di esclusione di Pauli e non possono pertanto occupare lo stesso stato quantico, in numero superiore a due.
Il principio spiega in modo semplice anche la periodicità degli elementi chimici. Quando infatti un livello energetico risulta pieno di elettroni, i successivi sono costretti a riempire il livello energetico successivo, dove si trovano orbite dello stesso tipo del precedente, anche se di dimensioni maggiori. Gli elettroni si distribuiscono nei vari livelli con andamento regolare e periodico.
Poiché poi sono gli elettroni più esterni a fornire le caratteristiche chimiche all'elemento diventa ovvia anche la periodicità di tali caratteristiche che si riscontra nella tavola periodica.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Numero quantico di spin e principio di esclusione di Pauli tipo file : doc
Numero quantico di spin e principio di esclusione di Pauli
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Numero quantico di spin e principio di esclusione di Pauli utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Numero quantico di spin e principio di esclusione di Pauli
Termini d' uso e privacy