Pesi atomici e molecolari relativi l’unità di massa atomica
Pesi atomici e molecolari relativi l’unità di massa atomica
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Pesi atomici e molecolari relativi l’unità di massa atomica
Se infatti volumi uguali di gas diversi nelle stesse condizioni di T e P contengono lo stesso numero di molecole, il rapporto tra il peso di due volumi uguali di gas diversi deve essere uguale al rapporto tra i pesi delle loro molecole. Naturalmente occorreva fissare il peso molecolare di un gas di riferimento rispetto al quale pesare tutti gli altri.
Venne scelto l'idrogeno, alla cui molecola biatomica venne assegnato un peso molecolare convenzionale pari a 2. In tal modo vennero calcolati i pesi atomici e i pesi molecolari relativi Pr all'idrogeno di molte sostanze. Nella prima metà dell'Ottocento, soprattutto ad opera di Berzelius (1779-1849), se ne conoscevano qualche migliaio.
Preso un volume fisso di un gas generico A avente peso WA ed un ugual volume di idrogeno avente peso 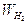 = 2, il peso molecolare relativo cercato (PrA) sarà dato dalla seguente proporzione:
= 2, il peso molecolare relativo cercato (PrA) sarà dato dalla seguente proporzione:
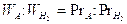
In effetti sarebbe più corretto parlare di massa atomica o molecolare relativa (mr) e non di peso. Si ricordi infatti che mentre la massa è una caratteristica costante di un corpo materiale , il suo peso dipende dal luogo in cui si misura, essendo il peso la forza di reciproca attrazione tra il corpo ed il pianeta (o in generale il corpo celeste) sul quale giace. Tuttavia, applicando la seconda legge della dinamica (f = ma), si osserva che il peso è direttamente proporzionale alla massa del corpo (P = mg), nell’ipotesi che l’accelerazione di gravità g sia costante su tutto il pianeta (ipotesi accettabile solo in prima approssimazione).
In chimica resta comunque molto diffusa l’abitudine di parlare di pesi atomici e di pesi molecolari, anche se ormai molti testi utilizzano più correttamente il termine ‘massa’.
Oggi non si usa più l’Idrogeno come unità di misura per pesare (massare) le sostanze, ma 1/12 della massa del Carbonio 12 (l’atomo di carbonio con un nucleo formato da 6 protoni e 6 neutroni ). Tale quantità è nota come unità di massa atomica (uma o u).
L’unità di massa atomica vale
1 u = 1,660 538 73 10-24 g
Utilizzando dunque come fattore di conversione (approssimato) 1,6605 10-24 g/u è possibile trasformare i pesi relativi (espressi in u) in pesi assoluti (espressi in g).
Pa (g) = Pr (u) 1,6605 10-24 (g/u)

Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Pesi atomici e molecolari relativi l’unità di massa atomica tipo file : doc
Pesi atomici e molecolari relativi l’unità di massa atomica
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Pesi atomici e molecolari relativi l’unità di massa atomica utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Pesi atomici e molecolari relativi l’unità di massa atomica
Termini d' uso e privacy