Potenziale di elettrodo
Potenziale di elettrodo
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Potenziale di elettrodo
Se inseriamo un voltmetro lungo il filo che unisce i due elettrodi possiamo naturalmente misurare la differenza di potenziale (in volts) che permette agli elettroni di scorrere lungo il filo da una semicella all'altra.
In modo analogo ai corpi dotati di massa che si muovono (se non vincolati) all'interno di un campo gravitazionale, spostandosi da punti a potenziale gravitazionale maggiore verso punti a gravitazionale minore, così anche le cariche elettriche si muovono sotto l'azione di un campo elettrico che si produce tra punti a diverso potenziale elettrico.
La differenza di potenziale elettrico V tra due punti viene definita come il lavoro necessario per spostare l'unità di carica elettrica da un punto all'altro.
1 Volt (J/C) è la differenza di potenziale esistente tra due punti quando il lavoro necessario per spostare la carica di 1 Coulomb è pari ad un Joule.
La differenza di potenziale tra i due elettrodi è quindi una misura della capacità della pila di compiere lavoro ed è quindi anche una misura della forza con cui gli elettroni che si liberano all'anodo durante l'ossidazione vengono spinti, lungo il circuito esterno, verso il catodo.
Sperimentalmente si osserva che tale differenza di potenziale, detta anche forza elettromotrice (f.e.m.) o tensione o voltaggio, dipende esclusivamente dal tipo di reazione redox, cioè dalla natura chimica dei reagenti (maggiore o minore tendenza a perdere o acquistare elettroni), dalla concentrazione delle specie chimiche e dalla temperatura (all'aumentare della temperatura e della concentrazione dei reagenti aumenta la differenza di potenziale).
Durante il funzionamento di una pila i reagenti si trasformano in prodotti di reazione. Poichè quindi le concentrazioni dei reagenti diminuiscono, anche la differenza di potenziale è destinata a calare fino ad azzerarsi. Quando la differenza di potenziale va a zero la pila è scarica ed in tali non è più in grado di produrre corrente elettrica.
In teoria la forza elettromotrice di una pila si può ottenere come differenza tra il potenziale di un elettrodo ed il potenziale dell'altro elettrodo.
Purtroppo però l'unica grandezza accessabile alla misura è la differenza di potenziale e non il potenziale assoluto di ciascuna semicella.
Infatti in una semicella isolata nella quale la specie ossidata è in equilibrio con la specie ridotta non avviene nessuna reazione. In potenza essa è in grado sia di fornire che di acquistare elettroni, ma in pratica lo fa solo quando viene collegata con un'altra semicella.
Solo collegandolo con un'altra semicella noi possiamo verificare se essa cederà o acquisterà elettroni e potremo effettivamente misurare la differenza di potenziale esistente.
E' come se avessimo tre bacini d'acqua disposti lungo un pendio e ci venisse richiesto di prevedere se il bacino centrale (B) è in grado di fornire o di ricevere acqua. E' evidente che per poter rispondere a tale domanda è necessario sapere se esso verrà collegato al bacino A, a monte, (dal quale riceve acqua) o al bacino C, a valle, (al quale cede acqua).
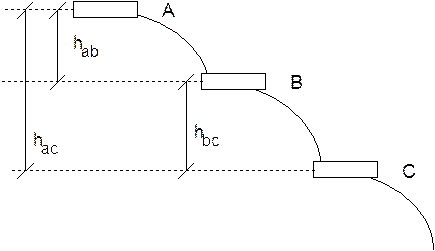
Analogamente, non è possibile misurare la quota di una montagna o di un fondale marino se non decidiamo rispetto a quale riferimento convenzionale (in genere il livello del mare) eseguiamo le misurazioni.
In tal modo non siamo in grado di misurare l'energia potenziale assoluta dell'acqua posta in una certa vasca (Ep = mgh), ma solo la sua energia potenziale rispetto ad un'altra vasca. Ad esempio possiamo misurare il potenziale della vasca A rispetto alle altre vasche conoscendone le differenze di quota (hab e hac) o il potenziale della vasca B rispetto alla vasca C conoscendone la differenza di quota (hbc). In definitiva quindi l'operazione che noi facciamo è una misura della differenza di potenziale tra le vasche.
Proseguendo con il nostro esempio, risulta evidente che se le vasche sono numerose non è comodo misurare i dislivelli tra tutte le coppie di vasche. E' infatti più semplice misurare per tutte le vasche la differenza di potenziale rispetto ad un'unica quota posta convenzionalmente come zero (generalmente il livello del mare, ma volendo qualsiasi altro punto di riferimento è ugualmente accettabile) e assumere tale valore come un valore di potenziale assoluto assegnato convenzionalmente a ciascuna vasca.
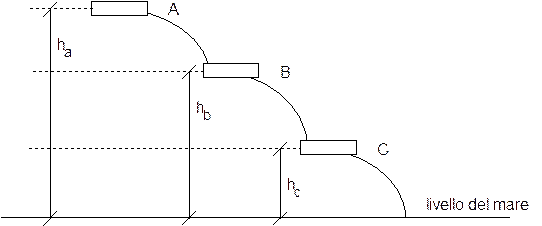
In tal modo quando sarà necessario potremmo sempre calcolare la differenza di potenziale tra due vasche utilizzando il loro potenziale calcolato rispetto ad un medesimo punto di riferimento (livello del mare). Si noti che cambiando il punto di riferimento (la quota assunta convenzionalmente come zero), i dislivelli non mutano e le differenze di potenziale rimangono inalterate. La differenza di potenziale tra le due vasche è una misura del lavoro che l'acqua può compiere quando scende dalla vasca più alta a quella più bassa o, il che è lo stesso, del lavoro che è necessario compiere sull'acqua per sollevarla dalla vasca più bassa a quella più alta.
In modo del tutto analogo, per non dover effettuare tutte le misurazioni di differenza di potenziale elettrico tra tutte le possibili coppie di semicelle, è stata arbitrariamente scelta una semicella alla quale è stato convenzionalmente assegnato potenziale zero. Poichè la differenza di potenziale varia con la temperatura e la concentrazione dei reagenti, si è inoltre convenzionalmente deciso di effettuare le misure alla temperatura di 25°C e con le specie chimiche alla concentrazione 1M (nel caso di gas pressione parziale di 1 atm).
La semicella assunta come elettrodo di riferimento è costituita dalla coppia redox H+/H2 ed è nota come elettrodo normale ad idrogeno.
Tale semicella viene realizzata immergendo un conduttore inerte (in genere platino) in una soluzione 1 M di ioni H+ ( si utilizza una soluzione 1 N di un acido forte). All'interno della soluzione viene fatto gorgogliare idrogeno gassoso alla pressione di 1 atm, in modo che vada a raccogliersi all'interno di una campana di vetro rovesciata in cui è ospitato l'elettrodo.
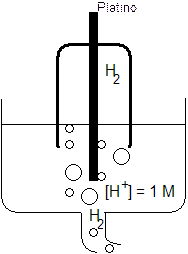
Alla semicella così realizzata viene dunque attribuito potenziale zero. Poichè poi si è convenuto di considerare la reazione di riduzione di ciascuna coppia redoxl, si attribuirà un potenziale positivo a tutte le coppie redox che effettivamente si riducono rispetto all'elettrodo ad idrogeno, ed un potenziale negativo a tutte quelle che si ossidano rispetto all'idrogeno.
Il catodo viene pertanto ad assumere sempre potenziale maggiore dell'anodo.
L'elettrodo ad idrogeno può quindi funzionare, a seconda delle coppie redox con cui viene messo in contatto, sia come anodo che come catodo (naturalmente ciò vale anche per qualsiasi altra coppia redox, che può ridursi o ossidarsi a seconda dei casi).
Deve essere chiaro che il potenziale di una certa semicella non è un potenziale assoluto, ma una differenza di potenziale con l'elettrodo normale ad idrogeno.
I valori in tal modo misurati per ogni coppia redox prendono il nome di Potenziali normali o standard di elettrodo (E°).
Se ad esempio poniamo la coppia redox Zn2+/Zn a contatto con l'elettrodo normale ad idrogeno, possiamo misurare una differenza di potenziale di 0.76 V.
Poichè lo zinco si ossida cedendo elettroni agli ioni H+ che si riducono ad idrogeno gassoso (possiamo verificarlo osservando che il pH della soluzione catodica aumenta), lo zinco funge da anodo mentre l'idrogeno da catodo. Dobbiamo pertanto assegnare alla coppia redox Zn2+/Zn un potenziale negativo pari a E° = - 0.76 V (il segno negativo ci informa che rispetto all'idrogeno la reazione di riduzione non è spontanea).
Zn / Zn2+ // H+ / H2
ANODO CATODO
Se invece poniamo la coppia redox Cu2+/Cu a contatto con l'elettrodo ad idrogeno, possiamo misurare una differenza di potenziale di 0,34 V.
Poichè in questo caso è l'idrogeno che si ossida cedendo elettroni al rame (possiamo verificarlo osservando che il pH della soluzione anodica diminuisce), l'idrogeno funge da anodo mentre il rame da catodo. Dobbiamo pertanto assegnare alla coppia redox Cu2+/Cu un potenziale positivo pari a E° = + 0.34 V (il segno positivo ci informa che rispetto all'idrogeno la reazione di riduzione è spontanea).
H2 /H+ // Cu2+ /Cu
ANODO CATODO
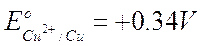
Nello stesso modo è possibile misurare i potenziali standard di molte altre coppie redox. Le coppie redox vengono poi ordinate per potenziali standard decrescenti in una tabella detta serie elettrochimica. Nella serie elettrochimica le coppie redox compaiono, come da convenzione, scritte nel senso della reazione di riduzione e i valori di potenziale associati a ciascuna coppia redox devono essere quindi interpretati come potenziali standard di riduzione.
In tal modo il confronto dei valori tabulati ci indica qual'è il senso spontaneo della reazione tra due coppie redox, infatti la coppia redox che presenta un potenziale standard di riduzione più elevato presenta anche la maggior tendenza a ridursi.
Prese quindi in considerazione due coppie redox, quella a potenziale più elevato subirà la riduzione e fungerà da catodo, mentre quella a potenziale minore subirà l'ossidazione e fungerà da anodo.
La forza elettromotrice della pila così costruita potrà essere prevista calcolando la differenza tra il potenziale standard di riduzione del catodo e quello dell'anodo
f.e.m. = E°catodo - E°anodo |
Ad esempio la forza elettromotrice della pila Daniell è
Naturalmente tale calcolo è possibile anche quando i potenziali standard di due coppie redox sono entrambi positivi o entrambi negativi.
Ad esempio se costruiamo una pila con la coppia redox Zn2+/Zn (E° = - 0,76 V) e Ba2+/Ba (E° = - 2,90 V), in questo caso lo zinco, che presenta potenziale maggiore si riduce e funge da catodo, mentre il bario, a potenziale minore, si ossida e funge da anodo.
La forza elettromotrice di tale pila sarà
Si tenga presente che i potenziali di riduzione riportati nella serie elettrochimica ci permettono, in generale, di fare delle previsioni sulla spontaneità delle reazioni redox. A parità di concentrazione (ricordiamo infatti che il potenziale varia con la concentrazione) ciascuna coppia redox tende ad ossidare le coppie redox a potenziale inferiore, mentre viene ossidata dalle coppie redox a potenziale maggiore.
Ad esempio tutti i metalli che presentano un potenziale di riduzione inferiore a quello dell'idrogeno (e quindi negativo), vengono ossidati (corrosi) da soluzioni 1N di acidi forti.
Quindi mentre il ferro (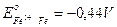 )
)
rimangono inalterati.
E' bene sottolineare che i potenziali di riduzione riportati nella serie elettrochimica misurano la tendenza della reazione ad avvenire e sono indipendenti dal numero di elettroni scambiati durante la reazione. Tenendo quindi presente che i potenziali sono sempre riferiti ad un singolo elettrone è possibile combinare opportunamente i potenziali di riduzione per ottenere valori relativi a semireazioni che non compaiono nella serie elettrochimica.
Ad esempio
|
|
E° |
n |
nE° |
1a reazione
|
Fe3+ + e Fe2+
|
0,77
|
1
|
0,77
|
2a reazione
|
Fe2+ + 2e Fe
|
- 0,44
|
2
|
- 0,88
|
reazione complessiva
|
Fe3+ + 3e Fe
|
|
3
|
- 0,11
|
La terza reazione risulta la somma delle prime due. Quindi, dopo aver moltiplicato ciascun potenziale per il numero di elettroni, si sommano algebricamente i valori ottenuti ottenendo il potenziale della reazione somma, riferito a 3 elettroni. Si calcola infine il potenziale per singolo elettrone, che nel caso particolare vale
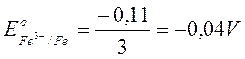
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Potenziale di elettrodo tipo file : doc
Potenziale di elettrodo
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Potenziale di elettrodo utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Potenziale di elettrodo
Termini d' uso e privacy