Processi Di Salificazione
Processi Di Salificazione
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Processi Di Salificazione
La formula chimica di un sale si può costruire come abbiamo appena esposto, ma i sali si producono attraverso numerose reazioni chimiche. Vediamo le principali.
Possiamo riassumere le principali reazioni di salificazione attraverso il seguente schema
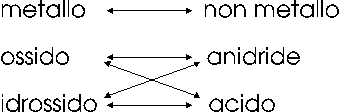
1) metallo + non metallo ® sale
2K + F2 ® 2KF (fluoruro di potassio)
2) ossido + anidride sale
MgO + SO3 ® MgSO4 (solfato di magnesio)
3) idrossido + acido ® sale + acqua
Ca(OH)2 + H2CO3 ® CaCO3 + H2O (carbonato di calcio)
4) ossido + acido ® sale + acqua
Na2O + H2SO3 ® Na2SO3 + H2O (solfito di sodio)
5) anidride + idrossido ® sale + acqua
P2O5 + 2KOH ® 2KPO3 + H2O (metafosfato di potassio)
Altri processi di salificazione
La salificazione può avvenire per sostituzione dell'idrogeno di un acido o dello ione metallico di un sale da parte di un metallo più elettropositivo (scambio semplice)
a) acido + metallo sale + idrogeno
H2SO4 + Zn ®ZnSO4 + H2 (solfato di zinco)
lo zinco, più elettropositivo dell'idrogeno, tende a cedergli i suoi elettroni. L'idrogeno diventa neutro e si libera come gas H2, mentre lo zinco diventa un catione e sostituisce l'idrogeno nell'acido trasformandolo in un sale. Gli acidi tendono dunque ad attaccare i metalli più elettropositivi dell'idrogeno, corrodendoli.
b) sale + metallo ® sale + metallo
ZnSO4 + 2Na ® Na2SO4 + Zn (solfato di sodio)
il sodio, più elettropositivo dello zinco, lo sostituisce nel sale, cedendogli i suoi elettroni e trasformandosi in ione sodio. Si libera zinco metallico.
La salificazione può avvenire infine per doppio scambio tra un acido e un sale e tra due sali.
c) acido + sale ® sale + acido
H2SO4 + CaCO3 ® H2CO3 + CaSO4 (solfato di calcio)
L'acido forte (acido solforico) sposta l'acido debole (acido carbonico) dai suoi sali (carbonati). Il processo è legato al diverso grado di dissociazione dei due acidi. Infatti lo ione carbonato, prodotto dalla dissociazione del carbonato di sodio, tende a ridare l'acido carbonico indissociato utilizzando gli ioni H+ provenienti dalla dissociazione dell'acido solforico.
d) sale + sale ®sale + sale
NaCl + AgNO3 ® AgCl¯ + NaNO3
Mentre il cloruro di sodio e il nitrato di argento sono molto solubili, il cloruro di argento è poco solubile. gli ioni Ag+ e Cl- presenti in soluzione tendono perciò a precipitare sotto forma di cloruro di argento, mentre in soluzione rimane il nitrato di sodio.
Sali basici
Oltre ai sali neutri e ai sali acidi esistono anche sali basici. Essi si formano quando in una reazione tra un idrossido ed un acido (o un'anidride) l'idrossido non si dissocia completamente e nella molecola del sale sono quindi presenti uno o più gruppi ossidrili
Mg(OH)2 + HCl ®MgOHCl + H2O (cloruro monobasico di magnesio)
Bi(OH)3 + HNO3 ® Bi(OH)2NO3 + H2O nitrato bibasico di bismuto)
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Processi Di Salificazione tipo file : doc
Processi Di Salificazione
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Processi Di Salificazione utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Processi Di Salificazione
Termini d' uso e privacy