Promozione ed ibridazione
Promozione ed ibridazione
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Promozione ed ibridazione
La promozione è il processo attraverso il quale un atomo "spaia" uno o più doppietti elettronici, trasferendo un elettrone di un doppietto ad un orbitale vuoto poco più energetico, ottenendo così due elettroni spaiati. Nonostante tale processo risulti energeticamente non favorito, la formazione di elettroni spaiati permette all'atomo di formare un numero maggiore di legami chimici che rendono complessivamente più stabile il sistema finale.
In altre parole il bilancio energetico finale rende comunque conveniente il processo di promozione.
La promozione è un altro meccanismo che, assieme al legame dativo, ci permette di spiegare la presenza di una valenza variabile per molti elementi chimici.
Ad esempio il manganese (Mn, Z = 25, VII gruppo B) presenta una configurazione superficiale con 5 elettroni negli orbitali 3d e 2 elettroni nell'orbitale 4s (3d5 4s2). In tali condizioni esso tende a dare ioni Mn2+, perdendo i due elettroni dell'orbitale s.
Esistono però altre configurazioni possibili, stabili in altre condizioni termodinamiche, in cui il manganese promuove gli elettroni degli orbitali d negli orbitali 4p.
Ad esempio
3d3 4s2 4p2 Mn 4+
3d° 4s2 4p5 Mn-
3d1 4s2 4p4 Mn2-
In modo analogo si comportano molti metalli della serie di transizione che presentano due livelli insaturi.
Un altro importante esempio di promozione è quello del carbonio. Il carbonio presenta una configurazione superficiale s2 p2 con 2 elettroni spaiati negli orbitali p con i quali si presume sia in grado di fare due legami covalenti.
In realtà il carbonio spaia facilmente gli elettroni dell'orbitale s, passando dalla configurazione stabile
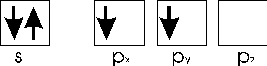
alla configurazione
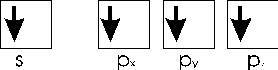
in cui un elettrone s è stato promosso in un orbitale vuoto pz.
In tal modo il carbonio è in grado di utilizzare 4 elettroni spaiati per effettuare altrettanti legami chimici covalenti, come accade ad esempio nel metano CH4.
ibridazione sp3
I 4 legami che si formano risultano essere però perfettamente equivalenti come forma, lunghezza ed intensità. In altre parole i 4 elettroni spaiati che si formano con il processo di promozione non occupano più un orbitale s e tre orbitali p, ma 4 orbitali perfettamente identici, che si sono formati dal mescolamento degli orbitali di partenza.
I 4 nuovi orbitali sono detti orbitali ibridi sp3 e possono essere rappresentati come quattro lobi che puntano verso i quattro vertici di un tetraedro di cui il carbonio occupa il centro.

L'ibridazione è dunque un processo di mescolamento degli orbitali. Gli orbitali ibridi che ne risultano sono più stabili degli orbitali originari. Nel caso particolare dell'ibridazione sp3, ciascun orbitale ibrido risulta essere equidistante da tutti gli altri (l'angolo tra gli orbitali è di 109° circa). Gli orbitali possono infatti essere pensati come nuvole negative che si respingono reciprocamente. La condizione di maggior stabilità risulta pertanto essere quella in cui viene resa massima la distanza reciproca.
ibridazione sp2
Il carbonio può produrre altri due tipi di ibridazioni. Ad esempio nel composto chimico CH2CH2, l'etilene o etene, il carbonio è ibridato sp2. In tal caso si mescolano 1 orbitale s e 2 orbitali p formando 3 orbitali ibridi sp2 che si dispongono su di un piano con angoli di 120° di distanza l'un l'altro. Il rimanente orbitale pz si dispone con due lobi perpendicolarmente al piano individuato dai tre orbitali sp2.
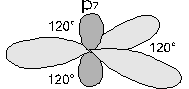
Ciascun atomo di carbonio impegna due orbitali ibridi per unirsi con un legame a due atomi di idrogeno. Con l'altro orbitale ibrido si unisce con l'altro atomo di carbonio ancora con un legame , mentre l'orbitale residuo pz forma un secondo legame di tipo con l'atomo di carbonio.
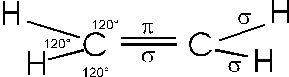
In generale l'ibridazione sp2 è caratteristica degli atomi di carbonio che presentano doppi legami reciproci.
Possiamo trovare un altro esempio di ibridazione sp2 nella molecola del fluoruro di boro BF3, con l'atomo di boro che promuove un elettrone del suo orbitale s in p e ibrida poi i suoi tre orbitali contenenti i tre elettroni spaiati.
Il fluoruro di boro è anche un caratteristico esempio di ottetto incompleto. Come si può osservare dallo schema, il boro, dopo aver condiviso i suoi tre elettroni con altrettanti provenienti dal fluoro, presenta solo 6 elettroni periferici. La regola dell'ottetto presenta quindi le sue eccezioni.
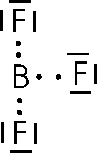
Ibridazione sp
Nell'acetilene HCCH, il carbonio risulta ibridato sp. Dopo aver spaiato i suoi 4 elettroni superficiali, il carbonio mescola infatti l'orbitale s e l'orbitale px, formando due orbitali sp che giacciono su di una retta formando angoli di 180°. i rimanenti orbitali non ibridati pY e pz si dispongono a 90° tra loro e con i due orbitali sp.
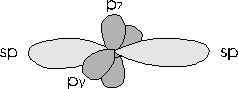
In tal modo nell'acetilene ciascun atomo di carbonio impegna i suoi due orbitali sp per effettuare due legami (uno con un atomo di idrogeno e uno con l'altro carbonio) e i due p non ibridati per formare altri due legami di tipo con l'altro atomo di carbonio. I due atomi di carbonio risultano pertanto uniti da un triplo legame.
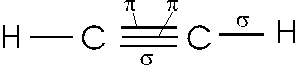
L'ibridazione sp è caratteristica del carbonio impegnato in tripli legami.
Un altro esempio di ibridazione sp ci viene offerto dal fluoruro di berillio BeF2, dove il berillio spaia i suoi due elettroni s, promuovendone uno in un orbitale px e procedendo all'ibridazione.
Anche in questo caso ci troviamo di fronte ad un caso di ottetto incompleto in quanto il berillio, dopo aver condiviso i suoi due elettroni con altrettanti provenienti dal fluoro, presenta solo 4 elettroni superficiali.

Ibridazioni più complesse
Se si prendono in considerazione elementi che presentano anche livelli d ed f si possono avere promozioni ed ibridazioni anche più complesse.
Il fosforo, ad esempio, che possiede 5 elettroni superficiali con una configurazione
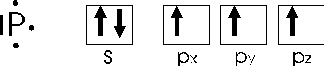
oltre a dare il tricloruro di fosforo PCl3, in cui condivide i tre elettroni spaiati degli orbitali p
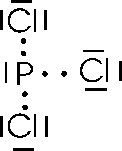
è in grado di dare anche un pentacloruro PCl5, in cui il fosforo promuove un elettrone 3s in un orbitale 3d vuoto, effettuando poi una ibridazione sp3d e condividendo i 5 elettroni spaiati così ottenuti con 5 atomi di cloro.
Il pentacloruro di fosforo è anche un esempio di ottetto espanso, in quanto il fosforo, dopo aver condiviso i suoi 5 elettroni spaiati con altrettanti provenienti dal cloro, si ritrova con 10 elettroni periferici.
Nell'esafluoruro di zolfo SF6, lo zolfo, che possiede 6 elettroni superficiali
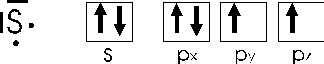
promuove un elettrone 3s e un elettrone 3px sistemandoli nei primi due orbitali 3d vuoti, ottenendo in tal modo ben 6 elettroni spaiati, utilizzabili per altrettanti legami chimici. I sei orbitali insaturi vengono quindi ibridati sp3d2.
Nell'esafluoruro di zolfo troviamo un altro esempio di ottetto espanso, in quanto lo zolfo, dopo aver condiviso i suoi 6 elettroni spaiati con altrettanti provenienti dal fluoro, si ritrova con 12 elettroni periferici.
La possibilità di espandere l'ottetto dipende evidentemente dalla presenza o meno di orbitali d ed f. Non è ad esempio possibile avere ottetti espansi per gli elementi del secondo periodo, che non possiedono orbitali di tipo d.
Mentre infatti esiste, come abbiamo visto, sia un tricloruro che un pentacloruro di fosforo, esiste solo un tricloruro di azoto NCl3, in quanto l'azoto non presenta orbitali d su cui promuovere i suoi elettroni s.
Inoltre la possibilità di legare un numero maggiore di atomi intorno ad un atomo centrale dipende anche dalle dimensioni di quest'ultimo.
Nell'esempio in questione l'atomo di fosforo risulta anche abbastanza grande perchè gli si dispongano intorno 5 atomi di cloro, mentre l'azoto risulta essere eccessivamente piccolo per ospitare più di tra atomi intorno ad esso.
Molecole con elettroni spaiati e paramagnetismo
Non sempre gli atomi utilizzano tutti i loro elettroni spaiati per effettuare legami chimici. In qualche caso può accadere che in una molecola sopravvivano degli orbitali insaturi.
Un tipico esempio di tale comportamento è rappresentato dal monossido e dal biossido di azoto.
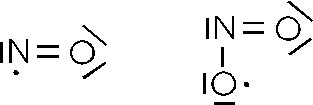
Tutte le sostanze che si trovano a possedere un elettrone spaiato risultano essere paramagnetiche, vengono cioè debolmente attratte dai poli di un magnete. Tale comportamento è dovuto proprio al debole campo magnetico associato all'elettrone, non compensato in questo caso da un elettrone con spin opposto.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Promozione ed ibridazione tipo file : doc
Promozione ed ibridazione
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Promozione ed ibridazione utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Promozione ed ibridazione
Termini d' uso e privacy