Rapporti ponderali calcolo delle quantità che reagiscono
Rapporti ponderali calcolo delle quantità che reagiscono
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Rapporti ponderali calcolo delle quantità che reagiscono
Ricordando che i coefficienti stechiometrici di un'equazione chimica bilanciata rappresentano, in scala macroscopica, il numero di moli delle sostanze che reagiscono è allora possibile determinare i rapporti in peso, o rapporti ponderali, tra le specie chimiche.
Ricordiamo che il numero di moli (n) di una sostanza chimica è pari al suo peso in grammi (W), diviso il suo peso molare (PM)
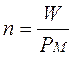
Se dunque dobbiamo calcolare a quanti grammi corrispondono 2,7 moli di anidride carbonica CO2, dopo aver calcolato il peso molare consultando la tabella periodica (PM = Peso atomico carbonio + 2 volte il Peso atomico dell'ossigeno = 12 + 2 x 16 = 44), si avrà
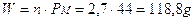
Esempi di calcolo ponderale
1) Data la reazione
CH4 + 2O2 ® CO2 + 2H20
Calcolare quanta acqua si forma bruciando 1 Kg di metano.
Dopo aver determinato il peso molare del metano (16 g) ed il peso molare dell'acqua (18g), li moltiplichiamo per i rispettivi coefficienti stechiometrici definendo in tal modo il rapporto in peso in cui reagiscono i due composti, pari a 16/36. In altre parole per ogni 16 grammi di metano che reagiscono si formano 36 grammi di acqua.
Possiamo allora impostare la seguente proporzione
16 : 36 = 1000 : x
che risolta ci da il seguente risultato: x = 2250 g
2) data la reazione
FeS + 2HCl ® FeCl2 + H2S
calcolare quanti grammi di cloruro ferroso si formano facendo reagire 100 g di solfuro ferroso con 80 g di acido cloridrico. Calcolare quale dei due reagenti non si consuma completamente e quanto ne rimane alla fine della reazione.
Il peso molare del solfuro ferroso FeS è 87,85 g, dell'acido cloridrico HCl 36,45 g ( 2 moli peseranno allora 2 x 36,45 = 72,9 g) , del cloruro ferroso FeCl2 126,75 g
Verifichiamo allora se 100 g di FeS reagiscono effettivamente con 80 g di HCl, impostando la seguente proporzione
87,85 : 72.9 = 100 : x
da cui x = 82,98 g di acido cloridrico
Ciò significa che 100 grammi di FeS reagiscono con 82,98 g di HCl. Ma nel sistema sono presenti solo 80 g di HCl. Ne deduciamo che non tutti i 100 g di FeS sono in grado di reagire, mentre l'acido cloridrico reagirà completamente. L'acido cloridrico rappresenta la specie chimica limitante.
Vediamo allora quanti grammi di FeS reagiscono con 80 g di HCl, impostando la seguente proporzione
87,85 : 72,9 = y : 80
da cui y = 96,41 g di FeS
Alla fine della reazione troveremo perciò che 100 - 96,41 = 3,59 g di FeS non hanno reagito.
Per calcolare ora quanto FeCl2 si forma possiamo impostare una proporzione partendo indifferentemente dal peso di HCl (80g) o di FeS (96,41 g) che reagiscono. Le due proporzioni sono le seguenti
72,9 : 126,75 = 80 : z
87,85 : 126,75 = 96,41 : z
da cui z = 139,1 g di FeCl2.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Rapporti ponderali calcolo delle quantità che reagiscono tipo file : doc
Rapporti ponderali calcolo delle quantità che reagiscono
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Rapporti ponderali calcolo delle quantità che reagiscono utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Rapporti ponderali calcolo delle quantità che reagiscono
Termini d' uso e privacy