Solubilità
Solubilità
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Solubilità
Una vecchia regola della chimica afferma che il simile scioglie il simile: solventi polari sciolgono sostanze ioniche o polari, mentre solventi apolari sciolgono sostanze apolari.
Come abbiamo già avuto modo di dire noi prenderemo in considerazione esclusivamente soluzioni acquose dove il solvente è l'acqua, un liquido molto polare.
Le parziali cariche elettriche dell'acqua esercitano sugli ioni o sulle molecole polari di un soluto un'attrazione che indebolisce considerevolmente le forze interne che mantengono integra la struttura del solido. Le particelle che si trovano sulla superficie del solido (polare o ionico) posto in acqua, finiscono quindi per essere estratte, circondate dalle molecole dell'acqua (solvatazione) e portate in soluzione. Se il solvente è l'acqua il fenomeno prende il nome di idratazione.
Si definisce solubilità la massima quantità di soluto che può essere disciolta in una data quantità di solvente. La solubilità è quindi la concentrazione della soluzione satura.
Il processo di solubilizzazione può essere sia esotermico che endotermico.
Effetti della temperatura sulla solubilità
In genere se il soluto è un solido il processo è endotermico (per questo motivo i soluti solidi si sciolgono meglio in liquidi caldi). Nonostante il processo non sia favorito dal punto di vista energetico esso risulta egualmente spontaneo poichè l'entropia di una soluzione è molto maggiore di quella di un solido cristallino (il grado di disordine è molto più elevato nei fluidi che nei solidi).
Se il soluto è un fluido (liquido o gas) in genere il processo di solubilizzazione è esotermico (per questo motivo i gas si sciolgono più facilmente in liquidi a bassa temperatura).
Effetti della pressione sulla solubilità (legge di Henry)
Poichè i solidi ed i liquidi sono praticamente incomprimibili la variazione della pressione non ha alcun effetto sulla loro solubilità.
Diverso è il caso di soluti gassosi. Infatti in soluzioni di gas in liquidi la concentrazione del soluto è proporzionale alla pressione parziale del gas in equilibrio con la soluzione.
La legge di Henry afferma che la molalità di una soluzione contenente un soluto gassoso è direttamente proporzionale alla pressione parziale del gas
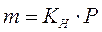
dove KH è la costante di Henry. La costante di Henry dipende sia dalla natura chimica del soluto che del solvente.
La legge di Henry spiega ad esempio perchè, stappando una bevanda gasata in cui è disciolta dell'anidride carbonica a pressione superiore a quella atmosferica, si formi improvvisamente dell'effervescenza. Trovandosi infatti bruscamente sottoposto ad una pressione esterna inferiore, il gas non è più in grado di rimanere in soluzione. Il processo è del tutto analogo a quello che provoca la formazione di bolle di gas (embolia) nel sangue dei sommozzatori che risalgono troppo rapidamente in superficie, sottoponendosi ad una brusca diminuzione di pressione.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Solubilità tipo file : doc
Solubilità
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Solubilità utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Solubilità
Termini d' uso e privacy