Velocità di reazione
Velocità di reazione
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
Velocità di reazione
Viene definita cinetica chimica quella branca della chimica che studia la dinamica delle reazioni chimiche ed in particolare la loro velocità.
Presa in considerazione una generica specie chimica A (reagente o prodotto di reazione), la velocità di una reazione si esprime come rapporto tra la variazione nella sua concentrazione D[A], nell'intervallo di tempo Dt preso in considerazione (è presente il valore assoluto poichè convenzionalmente la velocità viene espressa mediante valori positivi anche quando le variazioni del specie chimica considerata sono in diminuzione, come nel caso dei reagenti).
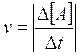
Ad esempio se la velocità di decomposizione dell'acido iodidrico in iodio e idrogeno (2HI à I2 + H2) è pari a 5 mmol l-1 s-1 ( 5 millimoli per litro per secondo), ciò significa che, mediamente si decompongono 5 millesimi di mole di acido iodidrico al secondo per litro di soluzione.
Naturalmente in tal modo si calcola la velocità media. La velocità istantanea è diversa e varia in genere con il procedere della reazione. Poichè il suo valore dipende nella maggior parte dei casi dalla concentrazione del reagente, esso presenta i valori più elevati all'inizio, quando la concentrazione è massima, per poi decrescere col procedere della reazione stessa, man mano che la concentrazione della specie chimica diminuisce. Ponendo in un diagramma cartesiano la concentrazione di una specie chimica A in funzione del tempo t, otteniamo
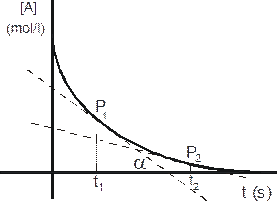
Per calcolare la velocità istantanea è necessario calcolare la derivata della curva in un punto. In pratica è sufficiente calcolare la pendenza della retta tangente alla curva nel punto desiderato, pari alla tangente trigonometrica dell'angolo che la retta forma con l'asse delle ascisse.
Nel figura si può ad esempio osservare come la velocità al tempo t1 sia pari alla pendenza della retta tangente alla curva nel punto P, pari a tana mentre al tempo t2 la pendenza della retta tangente sia minore e minore risulti pertanto anche la velocità istantanea.
I dati sperimentali suggeriscono che la velocità istantanea sia legata alla concentrazione dei reagenti da una relazione del tipo
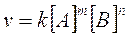
dove A e B sono due reagenti generici, m ed n sono rispettivamente il numero di molecole di A e B che effettivamente partecipano alla reazione. m è l'ordine della reazione rispetto al reagente A, mentre n è l'ordine della reazione rispetto a B.
k è una costante di proporzionalità, detta costante di velocità specifica.
Si definisce ordine complessivo della reazione la somma m + n degli esponenti a cui sono elevate le concentrazioni dei reagenti.
Generalmente m ed n coincidono con i coefficienti stechiometrici di A e B. Ciò non è comunque sempre vero. La determinazione dell'ordine di una reazione è infatti un dato sperimentale e dipende in ogni caso dal numero di particelle reagenti che effettivamente partecipano alla processo.
Per questo motivo molto spesso il valore assunto dall'ordine di una reazione può essere compreso solo attraverso la conoscenza del reale meccanismo di una reazione. Un esempio servirà a chiarire quanto affermato.
1) nella reazione 2HI à H2 + I2, la velocità dipende dal quadrato della concentrazione di HI
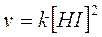
La reazione è dunque di secondo ordine e l'ordine coincide con il valore del coefficiente stechiometrico. Ciò perchè effettivamente il meccanismo di reazione richiede che si scontrino due molecole di HI per dare una molecola di H2 ed una di I2.
2) Nella reazione NO2 + CO à NO + CO2, la velocità dipende dal quadrato della concentrazione di NO2
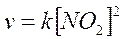
La reazione è dunque di secondo ordine e l'ordine non coincide con il coefficiente stechiometrico di NO2 e per di più non risulta nemmeno dipendere dalla concentrazione di CO. Per comprenderne il motivo è necessario far riferimento al meccanismo di reazione. La reazione avviene infatti in due stadi:
primo stadio - 2NO2 à NO3 + NO In cui è necessario lo scontro di due molecole di NO2. Per tale stadio la velocità sarà dunque 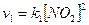
secondo stadio - NO3 + CO à NO2 + CO2 in cui è necessario lo scontro di una molecola di NO3 con una di CO. Per tale stadio la velocità sarà dunque 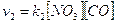
Poichè la velocità del primo stadio è molto minore della velocità del secondo stadio, la velocità della reazione complessiva coincide in pratica con la velocità del primo stadio.
Reazioni di primo ordine (cinetica di primo ordine)
Presentano una cinetica di primo ordine quelle reazioni in cui la velocità è direttamente proporzionale alla concentrazione di un solo reagente, secondo una legge del tipo
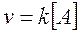
Ciò non significa che nella reazione non possa essere coinvolto più di un reagente, ma solo che la velocità dipende solo da uno dei reagenti presenti.
Nelle reazioni di primo ordine k si esprime in s-1 (infatti si ottiene come v/[A])
Più spesso viene utilizzata la relazione di velocità integrata (si ottiene integrando la relazione precedente) che mette in funzione la concentrazione con il tempo di reazione t
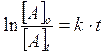
dove
[A]o = concentrazione iniziale di A
[A]t = concentrazione di A al tempo t
k = costante di velocità specifica
t = tempo di reazione
Così ad esempio sapendo che la reazione 2N2O5à 4NO2 + O2 segue una cinetica di primo ordine e che la costante di velocità specifica a 65°C vale k = 5,2.10-3 s-1, possiamo calcolare la concentrazione di N2O5 dopo 5 minuti, sapendo che la sua concentrazione iniziale era di 0,25 mol/l
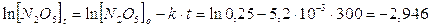
da cui 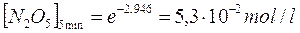
Seguono cinetiche di primo ordine anche i decadimenti radioattivi, per i quali si calcola generalmente il tempo di dimezzamento
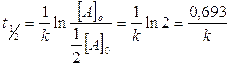
Come si può osservare, nel caso di cinetiche di primo ordine, il tempo di dimezzamento dipende solo dal valore di k e non dalla concentrazione iniziale. Nel caso dei decadimenti radioattivi k prende il nome di costante di decadimento radioattivo. Sapendo ad esempio che la costante di decadimento del carbonio14 è pari a 1,21.10-4 anni-1, possiamo facilmente calcolare il suo tempo di dimezzamento
Reazioni di secondo ordine (cinetiche di secondo ordine)
Presentano una cinetica di secondo ordine quelle reazioni in cui la velocità è direttamente proporzionale al prodotto delle concentrazioni di due reagenti oppure al quadrato della concentrazione di un solo reagente, secondo leggi del tipo
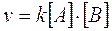
oppure
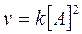
Nelle reazioni di secondo ordine k si esprime in l.mol-1.s-1.
Più spesso vengono utilizzate le relazioni di velocità integrata (si ottiene integrando una delle precedenti relazioni ) che mettono in funzione la concentrazione con il tempo di reazione t. Esse sono rispettivamente
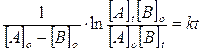
e
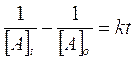
Sapendo, ad esempio, che la reazione 2HIà H2 + I2 segue una cinetica di secondo ordine e che la costante di velocità specifica a 800°K vale k = 9,2.10-2 l.mol-1.s-1, possiamo calcolare dopo quanto tempo la concentrazione di HI si è ridotta del 25%, sapendo che la sua concentrazione iniziale era di 5,3.10-2 mol/l
Reazioni di ordine zero (cinetica di ordine zero)
Presentano una cinetica di ordine zero quelle reazioni in cui la velocità è indipendente della concentrazione, secondo una legge del tipo
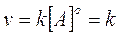
Un esempio di reazione di ordine zero è dato dalla decomposizione dell'ammoniaca su di un filo di platino riscaldato 2NH3  2. La velocità di decomposizione dell'ammoniaca rimane costante per tutto il processo.
2. La velocità di decomposizione dell'ammoniaca rimane costante per tutto il processo.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : Velocità di reazione tipo file : doc
Velocità di reazione
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come Velocità di reazione utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
Velocità di reazione
Termini d' uso e privacy