pH in soluzioni di Acidi e basi deboli poliprotici
pH in soluzioni di Acidi e basi deboli poliprotici
Questo sito utilizza cookie, anche di terze parti. Se vuoi saperne di più leggi la nostra Cookie Policy. Scorrendo questa pagina o cliccando qualunque suo elemento acconsenti all’uso dei cookie.I testi seguenti sono di proprietà dei rispettivi autori che ringraziamo per l'opportunità che ci danno di far conoscere gratuitamente a studenti , docenti e agli utenti del web i loro testi per sole finalità illustrative didattiche e scientifiche.
![]()
pH in soluzioni di Acidi e basi deboli poliprotici
Il calcolo del pH di acidi e basi deboli poliprotici, implicando più equilibri di dissociazione, ognuno caratterizzato da una propria costante di equilibrio, risulta essere più complesso. In generale è infatti necessario risolvere sistemi di più equazioni.
Molto spesso accade però che le costanti di dissociazione successive alla prima presentino valori molto minori. In tal caso è possibile dimostrare che la concentrazione di equilibrio degli ioni H+ dipende in pratica solo dal primo equilibrio. Inoltre i calcoli per la determinazione di tutte le concentrazioni di equilibrio possono venire notevolmente semplificati considerando ciascun equilibrio di dissociazione separatamente ed in modo indipendente dagli altri.
Per esemplificare quanto affermato calcoliamo il pH di una soluzione 0,5 M di acido solforoso, sapendo che la costante di prima dissociazione è
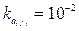 .
.
I due equilibri di dissociazione sono
H2SO3 H+ + HSO3-
HSO3- H+ + SO32-
Per risolvere correttamente il problema è necessario considerare contemporaneamente i due equilibri in quanto gli ioni H+ prodotti dalla prima dissociazione tendono a spostare verso sinistra il secondo equilibrio e viceversa.
Chiamando X il numero di mol/l di acido solforoso che si dissociano nel primo equilibrio e Y il numero di mol/l di HSO3- che si dissociano nel secondo equilibrio, avremo
per il primo equilibrio
|
iniziale |
d'equilibrio |
[H2SO3]
|
0,5
|
0,5 - X
|
[H+]
|
0
|
X + Y
|
[HSO3-]
|
0
|
X - Y
|
Infatti alle X mol/l di ioni H+ prodotti dal primo equilibrio è necessario aggiungere le Y mol/l di ioni H+ prodotti dal secondo equilibrio, mentre alle X mol/l di anioni HSO3- prodotti dal primo equilibrio è necessario togliere le Y mol/l che si dissociano nel secondo equilibrio.
per il secondo equilibrio
|
iniziale |
d'equilibrio |
[HSO3-]
|
0
|
X - Y
|
[H+]
|
0
|
X + Y
|
[SO32-]
|
0
|
Y
|
Sarebbe quindi necessario risolvere il seguente sistema di equazioni, che garantisce che entrambe le condizioni di equilibrio siano contemporaneamente soddisfatte.
La risoluzione risulta però lunga e laboriosa, generando tra l'altro un'equazione di grado superiore al secondo.
In questo caso possiamo comunque risolvere il problema in modo approssimato poiché la costante di seconda dissociazione risulta essere di ben 5 ordini di grandezza inferiore della costante di prima dissociazione e possiamo quindi ragionevolmente ritenere che gli ioni H+ prodotti dal secondo equilibrio siano trascurabili rispetto a quelli prodotti dal primo. E' possibile quindi considerare il primo equilibrio di dissociazione prevalente e procedere alla soluzione separata dei due equilibri.
Prendiamo dunque in considerazione il primo equilibrio come se non fosse presente il secondo
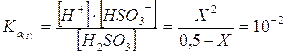
La soluzione dell'equazione di 2° grado ci fornisce il seguente valore
X = [H+]I = [HSO3-] = 6,59.10-2
Dove [H+]I rappresenta la concentrazione di ioni H+ prodotti dalla prima dissociazione.
Utilizziamo ora la concentrazione di HSO3- trovata, come concentrazione iniziale per la seconda dissociazione e teniamo conto in questo caso che gli ioni H+ provenienti dalla prima dissociazione spostano l'equilibrio verso sinistra
Essendo la Ka estremamente piccola Y avrà un valore che potrà essere tranquillamente trascurato sia nella somma a numeratore che nella differenza a denominatore. Otteniamo in tal modo il seguente risultato
Y = [H+]II = [SO32-] = 2,6.10-7
Come si può notare la concentrazione di ioni H+ provenienti dalla seconda dissociazione è talmente bassa che, anche se sommata alla concentrazione degli ioni H+ proveniente dalla prima dissociazione non ne modifica il valore
[H+]tot = [H+]I + [H+] II = X + Y = 6,59.10-2 + 2,6.10-7 = 6,59.10-2
Possiamo inoltre verificare che gli ioni H+ provenienti dalla seconda dissociazione sono in concentrazione talmente esigua da giustificare la trattazione separata del primo equilibrio. La loro presenza in soluzione sposta infatti l'equilibrio di prima dissociazione verso sinistra di una quantità assolutamente trascurabile.
In generale è possibile trattare gli equilibri separatamente, senza commettere grossi errori, quando le costanti di dissociazione differiscono di almeno 3 - 4 ordini di grandezza.
Fonte: http://digidownload.libero.it/quintaachimica/CHIMICA.doc
Autore del testo: non indicato nel documento di origine
Parola chiave google : pH in soluzioni di Acidi e basi deboli poliprotici tipo file : doc
pH in soluzioni di Acidi e basi deboli poliprotici
![]()
Se vuoi trovare velocemente le pagine inerenti un determinato argomento come pH in soluzioni di Acidi e basi deboli poliprotici utilizza il seguente motore di ricerca :
Visita la nostra pagina principale
pH in soluzioni di Acidi e basi deboli poliprotici
Termini d' uso e privacy